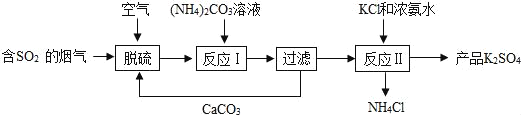
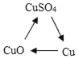
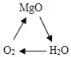
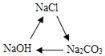
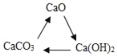
��Ŀ����
����Ŀ��ijCaCl2��Ʒ�У����ܺ���KNO3��CuCl2��MgCl2��NaCl��Na2CO3�е�ijЩ���ʣ�ȡ����Ʒ11.1g��������ˮ�У��õ��������ɫ��Һ��Ȼ�������м���������AgNO3��Һ���õ�28.7�˰�ɫ�����������Ʒ��ɵ������ƶ�����ȷ���ǣ�������
A. ֻ��MgCl2��û��NaCl
B. �϶�û��CuCl2��������Na2CO3
C. �϶���MgCl2��KNO3
D. ��Ʒ������CaCl2��NaCl��MgCl2���
���𰸡�D
��������
ȡ����Ʒ11.1����������ˮ�У��õ��������ɫ��Һ��˵��һ����������ɫ���Ȼ�ͭ��Һ��̼������Һ����Ϊ̼���ƺ��Ȼ��ƻᷴӦ����̼��Ƴ�����
�������м���������AgNO3��Һ���õ�28.7�˰�ɫ������ ![]() ���ɷ���ʽ��֪�Ȼ��ƺ��Ȼ�����������Ϊ111:287�����Կ�֪11.1g�Ǵ����Ȼ��ƣ������Ȼ���������Ϊ28.7g��
���ɷ���ʽ��֪�Ȼ��ƺ��Ȼ�����������Ϊ111:287�����Կ�֪11.1g�Ǵ����Ȼ��ƣ������Ȼ���������Ϊ28.7g��![]() ���ɷ���ʽ��֪11.1g�������Ȼ�þ��Ӧ�����Ȼ�������������Ϊ33.5g��
���ɷ���ʽ��֪11.1g�������Ȼ�þ��Ӧ�����Ȼ�������������Ϊ33.5g��![]() ���ɷ���ʽ��֪11.1g�������Ȼ��ƣ���Ӧ�����Ȼ�������������Ϊ27.2g ����Ϊ�Ȼ��Ʒ�Ӧ�����ij���������28.7g������������Ȼ�þ����һ�������Ȼ��ƣ�Ҫô���������ʶ�û�У�ֻ���в��ܷ�Ӧ������أ���ˣ�
���ɷ���ʽ��֪11.1g�������Ȼ��ƣ���Ӧ�����Ȼ�������������Ϊ27.2g ����Ϊ�Ȼ��Ʒ�Ӧ�����ij���������28.7g������������Ȼ�þ����һ�������Ȼ��ƣ�Ҫô���������ʶ�û�У�ֻ���в��ܷ�Ӧ������أ���ˣ�
A���������Ȼ�þ����һ�������Ȼ��ƣ���������ij��������28.7g����ѡ�����
B���Ȼ�ͭ��Һ����ɫ��̼���ƺ��Ȼ��Ʋ��ܹ��棬��Ʒ��һ��û��̼���ƣ���ѡ�����
C���������Ȼ�þ����һ�������Ȼ��ƣ��������Ȼ�þ������ص���ϣ���ѡ�����
D���������Ȼ�þ����һ�������Ȼ��ƣ���˿������Ȼ��ơ��Ȼ�þ���Ȼ��Ƶ���ϣ���ѡ����ȷ��
��ѡD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ʵ�������������أ�KClO3���Ͷ������̵Ļ������ȡ������ʵ�����Թ��й����������ʱ��仯��������ݼ��±�����ͨ������ش�
����ʱ��/min | 0 | t1 | t2 | t3 | t4 |
��������/g | 28.0 | 25.4 | 23.2 | 18.4 | 18.4 |
����ͨ������ش�
��1��ʵ������й��Ƶ�����_____g��
��2������ȫ��Ӧ�������̵�����Ϊ_____g��
��3��ԭ�����������ص���������___����д��������̣�