题目内容
【题目】实验探究题
Ⅰ探究物质在空气中和在氧气中燃烧
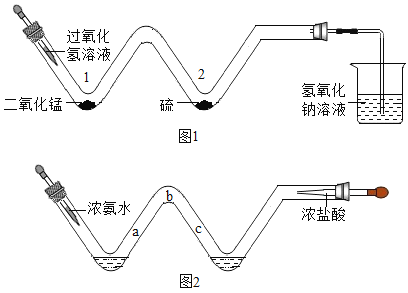
实验装置如图1所示,先点燃酒精灯,可观察到弯管2处有微弱的淡蓝色火焰,然后滴加过氧化氢溶液,过一会可观察到弯管2处的主要现象是_______________________。推测烧杯中氢氧化钠溶液的作用是_______________________。
Ⅱ探究微粒的性质
资料①:浓盐酸易挥发出氯化氢气体,浓氨水易挥发出(NH3),氨气与氯化氢气体相遇会产生大量白烟,这是因为两者发生化合反应生成了氯化铵固体,写出氨气与氯化氢气体发生反应的符号表达式____________________。
资料②:气体的相对分子质量越小,其分子的运动速率越快。(已知氯化氢的相对分子质量比氨气的大)
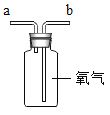
实验装置如图2所示:在长玻璃管外壁用记号笔做了a、b、c三个标记。实验开始时同时挤入浓氨水和浓盐酸,一会儿后玻璃管中产生大量的白烟。此现象说明分子具有的性质是___________________,你认为玻璃管中最浓厚的地方是 _________________
【答案】产生蓝紫色火焰 吸收SO2,防止污染空气 NH3+HCl![]() NH4Cl 分子在不断运动 c
NH4Cl 分子在不断运动 c
【解析】
Ⅰ、弯管1处过氧化氢在二氧化锰的催化作用下分解为水和氧气;在点燃的条件下,硫与氧气反应生成二氧化硫,硫在氧气中燃烧产生蓝紫色火焰;二氧化硫有刺激性气味,为了防止二氧化硫污染空气,可用氢氧化钠溶液吸收;
氨气与氯化氢气体反应生成氯化铵;反应的符号表达式NH3+HCl![]() NH4Cl。;②实验开始时同时挤入浓氨水和浓盐酸,一会儿后玻璃管中产生大量白烟,此现象能说明分子在不断的运动;氨气的相对分子质量小于氯化氢的相对分子质量,所以氨气分子运动速率大于氯化氢分子的运动速率,因此玻璃管中白烟最浓厚的地方是c。
NH4Cl。;②实验开始时同时挤入浓氨水和浓盐酸,一会儿后玻璃管中产生大量白烟,此现象能说明分子在不断的运动;氨气的相对分子质量小于氯化氢的相对分子质量,所以氨气分子运动速率大于氯化氢分子的运动速率,因此玻璃管中白烟最浓厚的地方是c。

 名校课堂系列答案
名校课堂系列答案