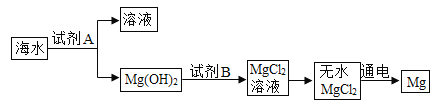
题目内容
【题目】在实验室中,化学兴趣小组的同学发现了一瓶敞口的氢氧化钠固体.他们对该固体的成分进行了定量实验称取固体21.3克放入锥形瓶中,加入一定量的水配制成50克溶液,再向锥形瓶中依次滴加20克盐酸充分反应.测得部分数据与图象如表.请根据有关信息回答问题.
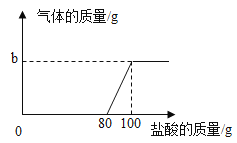
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入盐酸的质量 | 20 | 20 | 20 | 20 | 20 | 20 |
锥形瓶中物质的质量 | 70 | 90 | a | 130 | 147.8 | 167.8 |
(1)a的数值为 ,b的数值为 .
(2)兴趣小组的同学通过实验,得出该试剂已部分 变质的结论,其依据是(通过实验数据和图象做出你的分析) .
(3)计算恰好完全反应时所得溶液中溶质质量分数?(写出具体的计算过程).
【答案】(1) 110;2.2
(2)开始无气体产生,后来有气体产生
(3)19.8%
【解析】
(1)敞口放置的氢氧化钠固定会部分和空气中的二氧化碳反应生成碳酸钠,当加入稀盐酸时,HCl先和NaOH反应,后和碳酸钠反应;由表中的数据可知,第1、2、4次加入盐酸的质量就等于锥形瓶中增加的质量,所以第3次加入盐酸后物质的质量就是2次锥形瓶中物质的质量再加上盐酸的质量,故a的值为:90g+20g=110g,由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明了第5次加入的盐酸已将碳酸钠完全反应,则生成的二氧化碳的质量:120g+50g-167.8g=2.2g;
(2)得出该试剂已部分变质的结论,其依据是:滴加盐酸至80g时,开始时有二氧化碳生成,证明有碳酸钠存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钠反应,从而证明氢氧化钠存在;
(3)设固体中碳酸钠的质量为x,由碳酸钠反应生成的氯化钠质量为y,由氢氧化钠反应生成的氯化钠质量为z,则
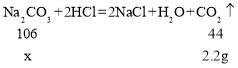
![]()
x=5.3g;
所以该固体中氢氧化钠的质量是21.3g-5.3g=16g;
根据钠元素守恒,有:
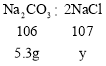
![]()
解得y=5.85g;
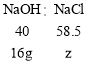
![]()
解得z=23.4g;
故恰好完全反应时所得溶液中溶质质量分数为![]() ;
;
答:恰好完全反应时所得溶液中溶质质量分数为19.8%。