题目内容
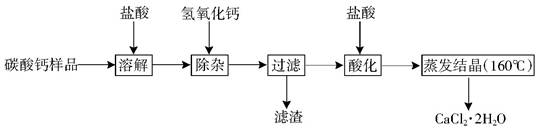
(6分)为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如下图所示的实验(假设该样品中只含有氯化钠一种杂质)。
请计算:
生成CO2气体的质量;
样品中碳酸氢钠的质量分数。
请计算:
生成CO2气体的质量;
样品中碳酸氢钠的质量分数。

(1)4.4g;(2)84%
试题分析:解:⑴根据质量守恒定律知生成的二氧化碳的质量为:10g+100g+100g-205.6g=4.4g
⑵设碳酸氢钠的质量为x
NaHCO3+HCl
 NaCl+H2O+CO2↑
NaCl+H2O+CO2↑ 84 44
X 4.4g

X=8.4g
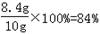
答:生成的二氧化碳的质量为4.4g,碳酸氢钠的质量分数为84g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目