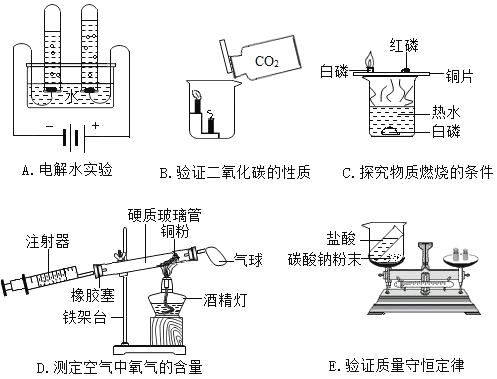
题目内容
【题目】某化学兴趣小组的同学做了一系列实验,请回答下列问题。
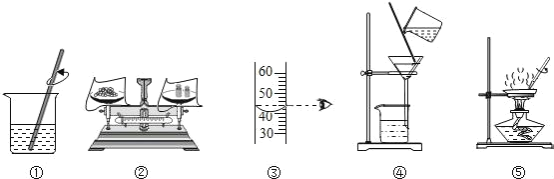
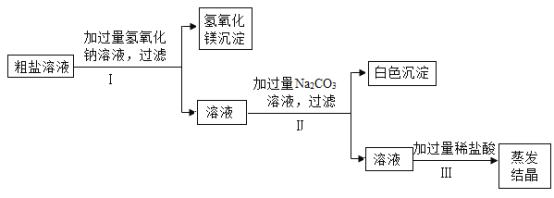
(1)粗盐提纯实验,如图所示:

①上图中有一处明显错误,请画图纠正__________。
②粗盐提纯实验中正确的操作顺序为_________(填操作序号);
③蒸发结晶中,玻璃棒搅拌的目的是___________。
(2)经测定,以上操作得到的晶体中含有少量的MgCl2、CaCl2, 杂质,为进一步提纯,将(1)中所得晶体配成溶液,并进行以下操作:
①请写出加入Na2CO3溶液后发生反应的化学方程式____。
②请说明加入过量盐酸的目的____。
(3)电解(2)中所得晶体配制成的溶液,通电发生反应: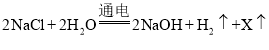 ,则X的化学式为_____。一段时间后,得到10%的氢氧化钠溶液30g,加_____g水可以稀释得到5%的氢氧化钠溶液。
,则X的化学式为_____。一段时间后,得到10%的氢氧化钠溶液30g,加_____g水可以稀释得到5%的氢氧化钠溶液。
(4)用5%的氢氧化钠溶液中和10g质量分数为7.3%的稀盐酸.恰好完全反应时,需要消耗多少克氢氧化钠溶液___?
【答案】 ABCED 防止因局部温度过高,造成液滴飞溅
ABCED 防止因局部温度过高,造成液滴飞溅 ![]() 除去过量的碳酸钠和氢氧化钠 C12 30 16g
除去过量的碳酸钠和氢氧化钠 C12 30 16g
【解析】
(1)过滤时需要用到玻璃棒引流,因此在图中添加一个玻璃棒; 。
。
粗盐的提纯方法有:取用、搅拌溶解、过滤、蒸发,顺序是ABCED。
蒸发结晶中,液体局部受热,热量不能及时散失,导致温度不均匀,会造成液体飞减,玻璃棒的作用是:防止因局部温度过高,造成液滴飞溅;
(2)①由于精盐晶体中含有MgCl2、CaCl2杂质,加入过量氢氧化钠后,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,氯化钙是少量,氢氧化钠和氯化钙不反应,经过滤后会得到氢氧化镁白色沉淀和氯化钠、氯化钙、氢氧化钠的混合液,向其中加入碳酸钠,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
②由于第二次过滤后的溶液中含有氢氧化钠,所以加入过量的稀盐酸的目的是除去溶液中的除去过量的碳酸钠和氯氧化钠。
(3)根据学反应前后原子的中类不变原子的个数相等,得反应前有2个钠原子,2个氯原子,4个氢原子和2个氧原子反应后有2个钠原子,4个氢原子和2个氧原子,则X中含有2个氯原子,X的化学式为Cl2;
根据溶液稀释前后溶质的质量不变,设加入水的质量为![]() ,则有30g×10%=(
,则有30g×10%=(![]() +30g)×5%,得出
+30g)×5%,得出![]() =30g;
=30g;
(4)设需要消耗5%的氯氧化钠溶液的质量为![]() ,
,

![]()
![]() =16g
=16g
答:需要消耗5%的氢氧化钠溶液的质量为16g。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
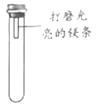
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________