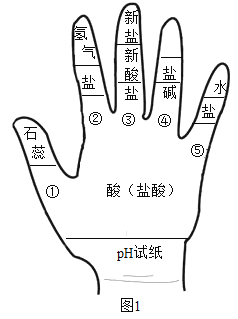
题目内容
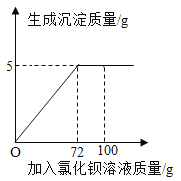
【题目】向50g Na2CO3溶液中逐滴加入一定溶质质量分数的CaCl2溶液。实验过程中,生成沉淀质量与加入CaCl2溶液的质量关系如右图所示,试计算:
(1)恰好完全反应时,生成沉淀的质量为______________g。
(2)计算恰好完全反应时,所得溶液中溶质的质量分数。
【答案】(1) 5;(2)5%
【解析】
试题分析:(1)由图像可知,恰好完全反应时,生成沉淀的质量为5g;(2)已知量:50g碳酸钠溶液;72g氯化钙溶液,沉淀碳酸钙5g,反应方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl;未知量为:所得溶液中溶质质量,所得溶液的质量;思路分析:由恰好反应时生成沉淀的质量结合化学方程式可以计算所得溶液中溶质氯化钠的质量; 设:生成氯化钠的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl(1分)
100 117
5g x
100:117=5g:x(1分)
x=5.85g(1分)
所得溶液的溶质质量分数=![]() ×100%=5%(2 分)
×100%=5%(2 分)
答: 略。
注: 设未知量和答,错写或漏写扣一分;写对不得分。
计算所得溶液溶质质量分数,列式正确得1分,计算结果正确得1分,共计2分.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目