题目内容
【题目】氯化钠和硝酸钾两种固体的溶解度曲线如右图所示。下列说法正确的是
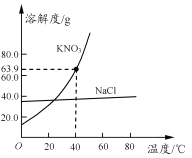
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
【答案】C
【解析】A、比较溶解度的大小要指明温度,错误;B、氯化钠的溶解度随温度的变化变化不大,故采用蒸发结晶的方法提纯,错误;C、40℃时,硝酸钾的溶解度为63.9g,即63.9g的硝酸钾溶解在100g水中恰好形成饱和溶液,那么50g水中能溶解31.95g硝酸钾,形成的溶液的溶质质量分数=![]() 39.0% ,正确;D、将20℃的硝酸钾饱和溶液升温至60℃,由于硝酸钾的溶解度变大,u硝酸钾由饱和溶液变成不饱和溶液,但溶质的质量分数不变,错误。故选C。
39.0% ,正确;D、将20℃的硝酸钾饱和溶液升温至60℃,由于硝酸钾的溶解度变大,u硝酸钾由饱和溶液变成不饱和溶液,但溶质的质量分数不变,错误。故选C。

【题目】某实验小组开展了如下有关碱的化学性质探究活动:

(1)实验1的目的是________________________________________________________________________;
(2)实验2中发生反应的化学方程式是________________________;
(3)实验3中观察到溶液由红色变为无色后,小萍想知道反应后溶液中除NaCl以外,是否还含有其他溶质(不考虑酚酞),于是她向反应后的溶液中加入一种试剂,从而得出了结论。小萍加入的试剂可能是________________________;
(4)通过上述实验探究活动,可以总结出碱的化学性质是
①碱能与酸发生中和反应;
②________________;
……
(5)准备实验时,小英发现药品室有两瓶未标注浓度的氢氧化钠溶液,经询问老师得知,该两瓶溶液的溶质质量分数分别为5%和10%。请设计实验方案完成对这两瓶溶液的鉴别(仅限以下实验用品:试管、量筒、滴管、酚酞溶液、10%盐酸)。
实验步骤 | 预计现象及 相应结论 |
__________________________ | ________________________________为5%的氢氧化钠溶液,另一种为10%的氢氧化钠溶液 |
【题目】某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动。请你一起参与他们的活动,并回答有关问题。
探究活动一:金属镍和铜的活动性顺序
实验方案 | 实验现象 | 实验结论 |
将金属镍加入到盛有硫酸铜溶液的试管中 | 溶液的颜色变浅,有______色固体析出 | 镍比铜的金属活动性强 |
若在生成物中Ni为+2价,则该反应的化学方程式为________________________。
实验过程中,小组同学还发现试管中有无色气体产生的“异常”现象,十分好奇,于是继续进行探究活动。
探究活动二:无色气体的成分是什么?
【猜想假设】A.氢气 B.氧气 C.二氧化硫 D.二氧化碳 E.一氧化碳
【分析推理】小明认为无色气体不可能是二氧化碳或一氧化碳,理由是___________________。
小红根据二氧化硫能够形成酸雨的事实,推测二氧化硫与二氧化碳的化学性质相似。小组同学认为小红的观点合理,于是将收集到的气体通入____________中,发现溶液________,证明无色气体不是二氧化硫。
综上所述,小组同学认为,无色气体可能是氢气,或者是氧气。
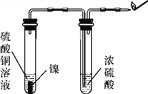
【设计方案】为确定气体成分,小组同学设计了如下实验方案:
用如图所示装置进行实验,先______________,然后将燃着的木条放在尖嘴处,发现气体燃烧并发出淡蓝色火焰,证明无色气体可能是氢气。
该实验方案中浓硫酸的作用是________________。
【评价与反思】小组同学认为,还可以补充一个实验,验证无色气体中含有氢元素,从而进一步证明无色气体可能是氢气。他们应补充的实验是__________________________________________________________________。