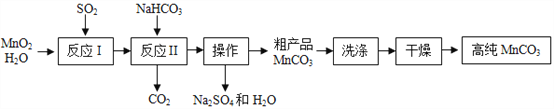
题目内容
【题目】金属是重要的资源,在日常生活中已得到越来越广泛的应用。
(1)铜常用于制作导线,因为其具有良好的__________________。
(2)将纯铝和铝合金相互刻画,纯铝上留下明显的划痕,说明_________。
(3)对汽车的部分钢铁部件进行喷漆可以防止其生锈,原因是_______。
(4)如图,向一定量AgNO3溶液中加入铜和锌的混合粉末,充分反应后过滤,得溶液甲和固体乙。
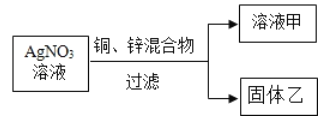
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的金属离子符号为________;此时向固体乙中加入稀盐酸,发生反应的化学方程式为__________,该反应类型为____________。
②若溶液甲显蓝色,是因为____________(用化学方程式表示),此时固体乙中一定含有的物质是_________。
【答案】 导电性 铝合金的硬度比纯铝的大(或纯铝的硬度比铝合金小) 隔绝空气(或隔绝氧气、水) Zn2+ Zn+2HCl=== ZnCl2+H2 ↑ 置换反应 Cu+2AgNO3===Cu(NO3)2+2Ag Ag(或银)
【解析】(1)铜常用于制作导线,因为其具有良好的导电性。(2)金属制成合金后,硬度变大。(3)铁生锈是铁与氧气、水发生反应的结果,在铁制品表面喷漆可以使铁制品与空气隔绝。(4)金属活动性顺序中,排在前面的金属能把排在后面的金属从其化合物的水溶液中置换出来,并且金属活动性差距越大,越容易发生反应,故首先发生的化学反应是:Zn+2AgNO3=2Ag+ Zn(NO3)2 ,其次是Cu+2AgNO3===Cu(NO3)2+2Ag,Zn +Cu(NO3)2 == Cu+ Zn(NO3)2
①若乙中含有锌、铜、银三种固体,由于锌还能与生成的Cu(NO3)2溶液反应,故溶液甲中所含的溶质是Zn(NO3)2,金属离子符号为Zn2+;固体乙中的锌能与稀盐酸反应,发生反应的化学方程式为:Zn+2HCl=== ZnCl2+H2 ↑,一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。②含Cu2+的溶液是蓝色,若溶液甲显蓝色,是因为Cu+2AgNO3===Cu(NO3)2+2Ag ,此时固体乙中一定含有的物质有生成的Ag。

【题目】小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 | 反应后 | |
装置A | 50g | 48.4g |
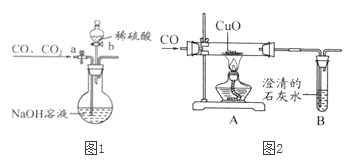
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。