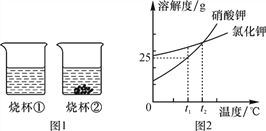
题目内容
【题目】小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 | 反应后 | |
装置A | 50g | 48.4g |
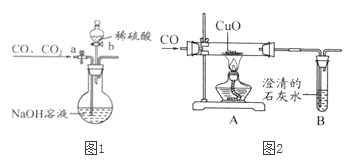
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。
【答案】 未进行尾气处理 ① 黑色固体逐渐变红 CO2+Ca(OH)2=====CaCO3↓+H2O 80% CO
【解析】本题考查了CO还原氧化铜的实验,二氧化碳的性质和化学式的计算。
(1)一氧化碳是有毒的气体,进行实验时要进行尾气处理,以防污染空气,该装置的不足之处是:没有尾气处理;
(2)一氧化碳属于易燃性气体,不纯时加热易爆炸,所以实验时要先通入一氧化碳,故选①;
(3)一氧化碳具有还原性,能与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙和水,实验过程中A和B处的实验现象分别是黑色粉末逐渐变红、澄清的石灰水变浑浊,B处的反应方程式是:CO2+Ca(OH)2=====CaCO3↓+H2O;
(4)根据化学方程式CO+CuO ![]() Cu+CO2可知固体减少的质量是参加活动反应的氧化铜中的氧元素质量,所以氧化铜中氧元素质量=50g-48.4g=1.6g,设:氧化铜的质量为x,
Cu+CO2可知固体减少的质量是参加活动反应的氧化铜中的氧元素质量,所以氧化铜中氧元素质量=50g-48.4g=1.6g,设:氧化铜的质量为x,
x÷![]() ×100%=1.6g,x=8g,CuO样品的纯度=
×100%=1.6g,x=8g,CuO样品的纯度=![]() ×100%=80%;
×100%=80%;
(5)关闭活塞b,打开活塞a时,通入的混合气体中的二氧化碳会与氢氧化钠反应生成碳酸钠,从而将二氧化碳除去,分离得到一氧化碳。