题目内容
【题目】小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂。为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
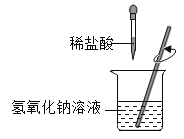
(1)实验过程中,玻璃棒的作用是______________。写出氢氧化钠和盐酸反应的化学方程式______________。
(2)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸有剩余。
小明同学却判定不可能是“氢氧化钠有剩余”,他的理由是______________。
(3)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写下表:
实验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中 | ______ | 盐酸过量 |
无明显现象 | 盐酸与氢氧化钠恰好完全反应 |
(4)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的,你认为其中不正确的是_______(填字母)。
A 硫酸钠粉末
B 氢氧化铜
C 生锈的铁钉
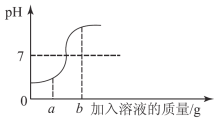
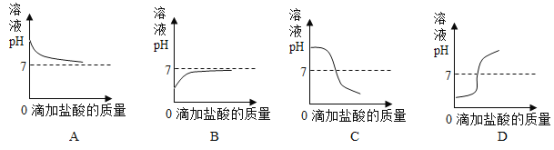
(5)下列曲线能够表示小红所做实验中溶液pH可能的变化趋势是_________________(填字母)。
(6)氢氧化钠是实验室常用药品,下列相关说法中,正确的是_________________(填字母)。
A 称量:可将NaOH固体直接放在天平左边托盘上进行称量
B 溶解:NaOH固体溶于水时放出热量
C 应急:先用大量水冲洗皮肤上的NaOH溶液,再涂上3%~5%稀盐酸
D 保存:NaOH固体易吸收空气中的水蒸气和CO2,应密封保存
【答案】搅拌 ![]() 氢氧化钠溶液能使酚酞试液变红色 有气泡产生 A C BD
氢氧化钠溶液能使酚酞试液变红色 有气泡产生 A C BD
【解析】
(1)实验过程中,将盐酸滴入氢氧化钠溶液,为使两种药品充分接触反应,玻璃棒的作用是搅拌,搅拌才可以使两种药品快速均匀反应;氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式![]() 。故填:搅拌;
。故填:搅拌;![]() 。
。
(2)小红认为此时烧杯中的溶液可能有以下三种情况:①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸有剩余。小明同学却判定不可能是“氢氧化钠有剩余”,他的理由是氢氧化钠溶液能使酚酞试液变红色,而题目中说加入酚酞后溶液无色,所以不可能是氢氧化钠有剩余。故填:氢氧化钠溶液能使酚酞试液变红色。
(3)他们共同设计了一个实验方案,欲对上述其他两种可能情况(是否有盐酸剩余)进行验证。将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中,如果看到有气泡产生,才能说明盐酸过量。故填:有气泡产生。
(4)可以代替锌粒的物质必须能与盐酸反应且有明显现象,硫酸钠粉末与盐酸不反应,无明显现象,所以硫酸钠粉末不可以代替锌粒;氢氧化铜是蓝色固体与盐酸反应固体溶解,溶液变蓝,所以氢氧化铜可以代替锌粒;生锈的铁钉与盐酸反应铁锈逐渐消失,溶液变黄,也可以代替锌粒。故填:A 。
(5)因为该实验是将稀盐酸滴入到氢氧化钠溶液中,所以溶液由碱性逐渐变为中性直至酸性,pH在逐渐降低,下列曲线能够表示小红所做实验中溶液pH可能的变化趋势的是C。故填:C。
(6)A. 氢氧化钠有很强烈的腐蚀性,称量NaOH固体时必须放在玻璃容器中,再放在天平左边托盘上进行称量,以防止腐蚀托盘。故A不符合题意;
B. NaOH固体溶于水时放出大量的热。故B符合题意;
C. NaOH溶液不慎沾到皮肤上,先用大量水冲洗皮肤上的NaOH溶液,再涂上硼酸溶液。故C不符合题意;
D. NaOH固体易吸收空气中的水蒸气和CO2,所以应密封保存。故D符合题意。
故选BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案