题目内容
【题目】黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸的用量/克 | 20 | 20 | 20 | 20 |
剩余固体的质量/克 | 20.0 | 17.4 | 14.8 | 13.5 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH_____7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)________毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。________
【答案】< 8.7mL 优良
【解析】
(1)根据第二次和第三次固体都是减少了2.6g,所以第一次也是减少2.6g,所以样品质量为20.0g+2.6g=22.6g,而第四次只减少了1.3g,所以此时硫酸过量。所以第4次实验结束后溶液的pH<7。故填:<
(2)根据溶液稀释过程中溶质的质量不变,配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克厘米3)。设需要的浓硫酸的体积为x,x×1.84克/厘米3×98%=80g×19.6%;x≈8.7厘米3=8.7mL。故填:8.7mL
(3)样品中铜的质量分数为![]() ×100%≈59.7%介于59%﹣65%之间,所以性能优良。故填:优良
×100%≈59.7%介于59%﹣65%之间,所以性能优良。故填:优良

 阅读快车系列答案
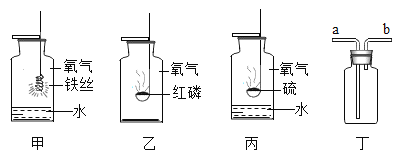
阅读快车系列答案【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.

内容 步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导 管口放置一小块白磷,塞 紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭 点燃木炭后,迅速将燃烧 匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为_____.
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是_____; 推入H2O2溶液后,观察到烧杯中的现象是_____.
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是_____;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是_____.