题目内容
“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水分解因素”的实验:取两只大试管,分别倒入适量浓度为3%、15%双氧水,再加入等质量的二氧化锰(MnO2),用排水集气法各收集一小试管气体,发现浓度大的先收集满.
(1)写出上述反应的化学方程式:
(2)该实验不用排空气法收集气体的原因是
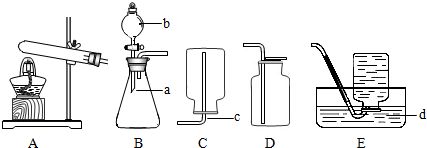
(3)对于该实验,某同学采用如下操作进行:a、检验装置的气密性;b、待有连续稳定气泡冒出时再排水收集气体;c、将水槽中待收集气体的小试管注满水;d、旋紧连有导气管的单孔橡胶塞;e、向大试管内倒入适量双氧水再加入少量二氧化锰粉末.实验过程中合理的操作顺序是
(4)根据实验目的和实验现象,你将得出的实验结论是
(1)写出上述反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)该实验不用排空气法收集气体的原因是
用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满)
用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满)
.(3)对于该实验,某同学采用如下操作进行:a、检验装置的气密性;b、待有连续稳定气泡冒出时再排水收集气体;c、将水槽中待收集气体的小试管注满水;d、旋紧连有导气管的单孔橡胶塞;e、向大试管内倒入适量双氧水再加入少量二氧化锰粉末.实验过程中合理的操作顺序是
ca(或ac)edb
ca(或ac)edb
.实验过程中要“待有连续稳定气泡冒出时再排水收集气体”而不是一旦观察到气泡就开始收集的原因是刚开始排出的是试管中原有的空气
刚开始排出的是试管中原有的空气
.(4)根据实验目的和实验现象,你将得出的实验结论是
其它条件相同时,双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快)
其它条件相同时,双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快)
.分析:(1)根据书写方程式原则书写
(2)根据实验目的分析收集方法
(3)根据实验操作步骤分析
(4)根据实验目的和实验现象分析得出实验结论
(2)根据实验目的分析收集方法
(3)根据实验操作步骤分析
(4)根据实验目的和实验现象分析得出实验结论
解答:解:(1)双氧水分解生成水和氧气,化学方程式为:2H2O2
2H2O+O2↑.
(2)此题实验目的是探究影响双氧水分解速率的因素,需要观察收集相同体积的氧气所需时间的多少,用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满)因此不能用排空气法收集.
(3)双氧水制取氧气的操作步骤是先检验装置的气密性;在加药品前将水槽中待收集气体的小试管注满水;(这两步顺序可颠倒)然后向大试管内倒入适量双氧水再加入少量二氧化锰粉末,旋紧连有导气管的单孔橡胶塞;待有连续稳定气泡冒出时再排水收集气体;合理的操作顺序是 ca(或ac)edb.因刚开始排出的是试管中原有的空气.因此实验过程中要“待有连续稳定气泡冒出时再排水收集气体”.
(4)此题实验目的是探究“影响双氧水分解因素”,此题是通过比较不同浓度的双氧水分解收集等体积的氧气所需时间的长短来探究双氧水浓度与分解速率的关系,因此可得出的实验结论是其它条件相同时 双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快)
故答案为:(1):2H2O2
2H2O+O2↑;
(2)用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满);
(3)ca(或ac)edb 刚开始排出的是试管中原有的空气;
(4)双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快).
| ||
(2)此题实验目的是探究影响双氧水分解速率的因素,需要观察收集相同体积的氧气所需时间的多少,用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满)因此不能用排空气法收集.
(3)双氧水制取氧气的操作步骤是先检验装置的气密性;在加药品前将水槽中待收集气体的小试管注满水;(这两步顺序可颠倒)然后向大试管内倒入适量双氧水再加入少量二氧化锰粉末,旋紧连有导气管的单孔橡胶塞;待有连续稳定气泡冒出时再排水收集气体;合理的操作顺序是 ca(或ac)edb.因刚开始排出的是试管中原有的空气.因此实验过程中要“待有连续稳定气泡冒出时再排水收集气体”.
(4)此题实验目的是探究“影响双氧水分解因素”,此题是通过比较不同浓度的双氧水分解收集等体积的氧气所需时间的长短来探究双氧水浓度与分解速率的关系,因此可得出的实验结论是其它条件相同时 双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快)
故答案为:(1):2H2O2
| ||
(2)用排空气法收集时,不便于观察到试管中气体是否收集满(或不能直接看出试管中的气体是否收集满);
(3)ca(或ac)edb 刚开始排出的是试管中原有的空气;
(4)双氧水分解速率与其浓度有关(或双氧水浓度越大,分解的速率就越快).
点评:本题考查双氧水制氧气的原理、操作步骤、收集方法以及根据实验目的、实验现象分析得出结论的能力,注意结来源于实验目的和过程.

练习册系列答案
相关题目
 “化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.
“化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.