题目内容
 “化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.
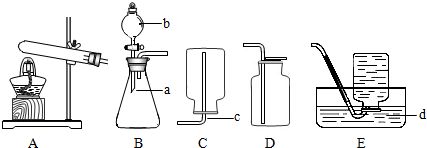
“化学反应条件的控制是实验灵魂”.某校化学兴趣小组在老师指导下,进行了“影响过氧化氢溶液分解因素”的实验.请你帮助回答下列问题.(1)用试管进行排水法收集氧气时,主要出现了如右图所示的3种操作,其中合理的是
A
A
.(填序号).(2)取a、b两支试管加入等体积6%的过氧化氢溶液,再分别加入少许MnO2粉末、CuO粉末,发现a 中比b中产生气泡多且快.随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃.由此得出影响过氧化氢溶液分解的因素是
催化剂的种类
催化剂的种类
.(3)事实上,有许多因素可能影响过氧化氢溶液分解的快慢.请说出你的一个猜想
温度升高,过氧化氢溶液分解的速率加快等(合理即可)
温度升高,过氧化氢溶液分解的速率加快等(合理即可)
.分析:(1)根据用排水法收集氧气的注意事项进行分析解答.
(2)控制实验条件作对比实验,催化剂的种类和实验结果的对应关系.
(3)影响化学反应速率有很多因素,如反应物的浓度、温度、颗粒大小、接触面积等都能够影响反应速率.
(2)控制实验条件作对比实验,催化剂的种类和实验结果的对应关系.
(3)影响化学反应速率有很多因素,如反应物的浓度、温度、颗粒大小、接触面积等都能够影响反应速率.
解答:解:(1)用排水法收集氧气,伸入试管内的弯管不宜太长,否则不利于观察氧气的排出速率,且从水槽中移出试管时也不方便.
(2)取a、b两支试管加入等体积6%的过氧化氢溶液,再分别加入少许MnO2粉末、CuO粉末,发现a 中比b中产生气泡多且快.随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃;在实验条件中只有催化剂不同,对应的反应速率不同,说明影响反应速率的是催化剂种类.
(3)影响化学反应快慢的因素很多,如催化剂二氧化锰能加快双氧水的分解速率,另外反应物的浓度、温度、颗粒大小、接触面积等,也会影响化学反应快慢.所以可做出以下猜想:温度升高,过氧化氢溶液分解的速率加快;或过氧化氢溶液的浓度越大,过氧化氢溶液分解的速率加快等.
故答案为:(1)A;(2)催化剂的种类;(3)温度升高,过氧化氢溶液分解的速率加快等(合理即可).
(2)取a、b两支试管加入等体积6%的过氧化氢溶液,再分别加入少许MnO2粉末、CuO粉末,发现a 中比b中产生气泡多且快.随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃;在实验条件中只有催化剂不同,对应的反应速率不同,说明影响反应速率的是催化剂种类.
(3)影响化学反应快慢的因素很多,如催化剂二氧化锰能加快双氧水的分解速率,另外反应物的浓度、温度、颗粒大小、接触面积等,也会影响化学反应快慢.所以可做出以下猜想:温度升高,过氧化氢溶液分解的速率加快;或过氧化氢溶液的浓度越大,过氧化氢溶液分解的速率加快等.
故答案为:(1)A;(2)催化剂的种类;(3)温度升高,过氧化氢溶液分解的速率加快等(合理即可).
点评:本题浓度表示很大,主要考查影响反应速率的因素,了解影响化学反应速率的因素是正确解答本题的关键.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目