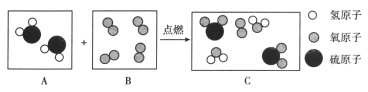
题目内容
【题目】通过一年的化学学习,相信你已经掌握了一些化学知识与实验探究能力。
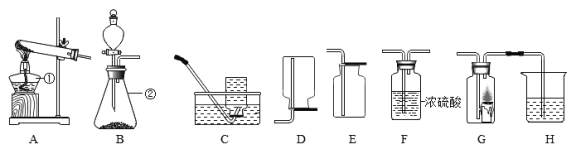
Ⅰ.请结合下列实验装置图回答问题。
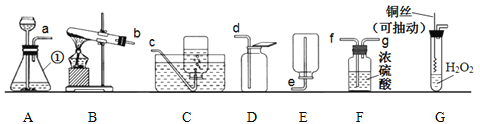
(1)写出图中①的仪器名称:_______________。
(2)实验室用过氧化氢制取氧气的化学方程式为_______________,实验室用此反应原理制取并收集一瓶干燥的氧气,应选用的装置连接顺序为_______________ (选填小写字母).
(3)查阅资料:氧化铜可以用作过氧化氢分解制氧气的催化剂。现有一根洁净的铜丝,实验前先将其绕成螺旋状,再经加热处理。改进后发生装置如图G所示(已略去夹持装置)。
①铜丝绕成螺旋状的作用是____________(填序号)。
A 收集到更多的氧气 B 加快反应速率 C 没有影响
②与装置A比较,改进后装置的优点是______________。
Ⅱ.过氧化钠(Na2O2)是淡黄色固体,保存不当会变质而发白色。化学兴趣小组查得以下资料,对于过氧化钠变质的原理,有两种不同的原因:
甲:2Na2O2 + 2CO2 ═ 2Na2CO3 + O2
乙:2Na2O2 + 2H2O ═ 4NaOH + O2↑
为探究过氧化钠变质原理的合理性,开展以下实验:
(实验过程)
[实验1]取适量保存不当而变质发白色的固体于试管中,加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是__________(用化学方程式表示)。
(2)化学兴趣小组认为:据此现象,还不能得出“反应甲是造成过氧化钠变质的原因”的结论。理由是______________。
[实验2]兴趣小组设计了如图的实验装置,探究二氧化碳与过氧化钠反应。B中盛有饱和碳酸氢钠溶液,可除去二氧化碳中混有的________________ 气体。方程式为_________
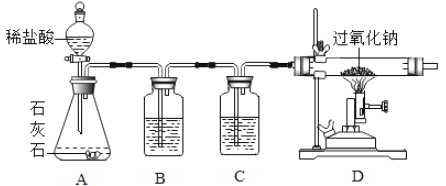
(3)C中盛有浓硫酸,其作用是__________。
(4)在D中观察到______________现象时,说明二氧化碳与过氧化钠发生了化学反应。
【答案】锥形瓶 2H2O2![]() 2H2O+O2↑ afgd B 控制反应的发生和停止 Ca(OH)2+CO2=CaCO3↓+H2O 无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的 氯化氢 NaHCO3+HCl=NaCl+H2O+CO2↑ 吸收水蒸气 淡黄色固体变白色
2H2O+O2↑ afgd B 控制反应的发生和停止 Ca(OH)2+CO2=CaCO3↓+H2O 无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的 氯化氢 NaHCO3+HCl=NaCl+H2O+CO2↑ 吸收水蒸气 淡黄色固体变白色
【解析】
Ⅰ
(1)图中①的仪器名称是锥形瓶;
(2)过氧化氢在二氧化锰的催化作用下分解为水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;该反应的反应物是固体与液体,在常温下进行,选择装置A来制取,收集一瓶干燥的氧气,用浓硫酸来进行干燥,干燥时长管进气,短管出气,用向上排空气法来收集应选用的装置连接顺序为afgd;
2H2O+O2↑;该反应的反应物是固体与液体,在常温下进行,选择装置A来制取,收集一瓶干燥的氧气,用浓硫酸来进行干燥,干燥时长管进气,短管出气,用向上排空气法来收集应选用的装置连接顺序为afgd;
(3)①将铜丝绕成螺旋状,增大了与反应物的接触面积,加快了反应的速率,故选B;
②改进后的装置,通过上、下抽动铜丝来控制铜丝与过氧化氢溶液的接触,控制反应的发生和停止。
Ⅱ
[实验1]
(1)石灰水变浑浊的原因是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)化学兴趣小组认为:据此现象,还不能得出“反应甲是造成过氧化钠变质的原因”的结论,理由是无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的;
[实验2]
盐酸具有挥发性,制得的二氧化碳气体中混有少量的氯化氢气体,氯化氢气体溶于水形成盐酸,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,B中盛有饱和碳酸氢钠溶液,可除去二氧化碳中混有的氯化氢气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)C中盛有浓硫酸,浓硫酸具有吸水性,其作用是吸收水蒸气;
(4)过氧化钠(Na2O2)是淡黄色固体,碳酸钠是白色粉末,在D中观察到淡黄色固体变白色时,说明二氧化碳与过氧化钠发生了化学反应。

 名校课堂系列答案
名校课堂系列答案【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。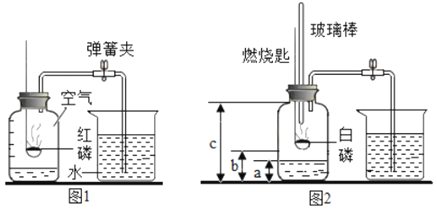
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
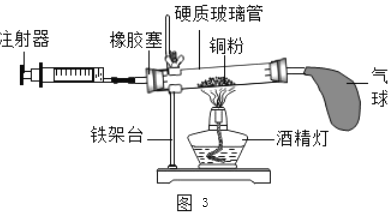
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。