题目内容
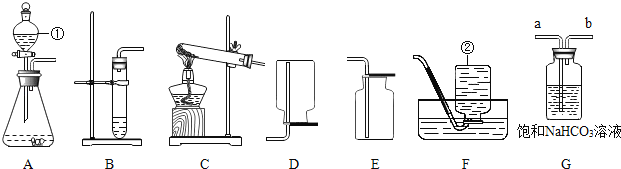
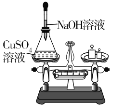
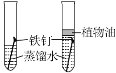
【题目】如图,为某学习小组探究金属化学性质时所做的四个实验,仔细分析回答下列问题:

(1)实验前用砂纸打磨金属的目的是_______________;
(2)D中除了观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈________,铁与稀硫酸恰好完全反应后溶液中的溶质是____________;
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是_________(填序号),由此判断出三种金属的活动性由强到弱的顺序是_______________;
(4)除去铜粉中的少量铁粉可以用___________溶液.
【答案】除去金属表面的氧化层,使金属充分接触溶液 浅绿色 FeSO4 A、B Fe>Cu>Ag 硫酸铜
【解析】
(1)金属表面可有存在氧化薄膜层,用砂纸打磨能除去氧化层,使金属与溶液充分接触
(2)铁与稀硫酸反应生成硫酸亚铁和氢气,方程式为H2SO4+Fe=FeSO4+H2↑,且Fe2+为浅绿色
(3)要确定Cu、Fe、Ag的活动性顺序,要能知道铜能否置换银,银能否置换铁,铁能否置换铜。因此只用A和B就能确定Cu>Ag和Fe>Cu,所以活动性Fe>Cu>Ag
(4)D实验证明Fe能与硫酸铜溶液反应,因此可用硫酸铜溶液除去Cu中混的少量Fe
故答案为:除去金属表面的氧化层,使金属充分接触溶液;浅绿色;FeSO4;A、B;Fe>Cu>Ag;硫酸铜

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目