题目内容
【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
(猜想)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
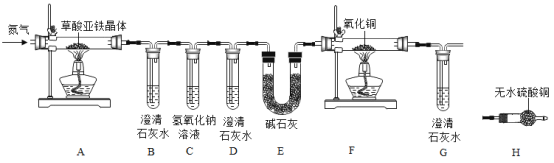
(实验方案)按照上图连接好装置后,加入药品前应该进行的实验操作 (夹持装置未画出) _______(填操作名称)。
(问题讨论)
(1)实验开始前需要先鼓入一段时间的N2 , 该操作的目的为_______
(2) C中氢氧化钠溶液的作用是_______;
(3)(结果分析)定性
①试管B中出现浑浊,证明产物中有_______存在;证明分解产物中存在CO的现象是_______。
②小明认为应增加H装置,则H装置应放在_______两个装置之间,若观察到_______, 则证明有水生成;
(4) (反思评价)从环保角度考虑,该套实验装置的明显缺陷是_______;
【答案】检查装置气密性 通入N2排除装置内的空气,避免空气中CO2对实验造成的干扰 吸收二氧化碳,防止影响CO的检验 CO2 D中澄清石灰水不出现浑浊,G中澄清石灰水出现浑浊(F内固体变红) AB 白色粉末变蓝 没有吸收尾气中的一氧化碳,对空气可能造成污染
【解析】
(1)加入药品前,应该进行的实验操作是检验装置气密性,故填写:检查装置气密性;
(2)分析装置图可知,通入氮气提供惰性环境,避免干扰分解产物的分析和验证,故填写:通入N2排除装置内的空气,避免空气中CO2对实验造成的干扰;
(3)C中盛放氢氧化钠溶液,吸收二氧化碳,防止影响CO的检验,故填写:吸收二氧化碳,防止影响CO的检验;
(4)B中是澄清石灰水,生成沉淀证明产生的气体中有二氧化碳,故填写:CO2;
证明产生气体中有一氧化碳可以利用装置D中澄清石灰水不变浑浊,一氧化碳还原氧化铜反应生成二氧化碳通过G中澄清石灰水变浑浊,同时,F内黑色粉末变红,故填写:D中澄清石灰水不出现浑浊,G中澄清石灰水出现浑浊(F内固体变红);
结晶水合物分解生成水蒸气,在AB间加一个能够检验水蒸气的无水硫酸铜的干燥管证明水蒸气的生成,故填写:AB;
白色无水硫酸铜粉末遇水会变为蓝色五水硫酸铜,故填写:白色粉末变蓝;
(5)草酸亚铁晶体分解会产生CO、CO2和H2O三种气体,一氧化碳会污染空气,故填写:没有吸收尾气中的一氧化碳,对空气可能造成污染。

 名校课堂系列答案
名校课堂系列答案【题目】我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
(方案一)样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
实验操作 | 实验现象 | 实验结论 |
取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式: ______________________ |
(2)分析滴加的CaCl2溶液要过量的原因:________________________。
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算出Na2CO3的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为_________。
(方案二)样品与稀硫酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀硫酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好且每步反应或作用都是完全的)。
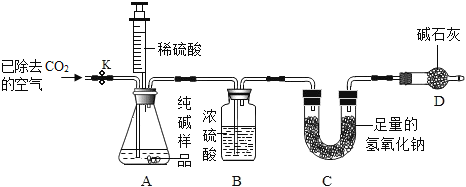
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,再接上装置C和D。其目的是__________________________________________________。
(5)关闭止水夹K,加入足量的稀硫酸(杂质不与稀硫酸反应),装置A中样品产生气体的化学方程式为__________________________________________。该方案中不能用稀盐酸代替稀硫酸的原因是_______________________________________。
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是____________________________________________。根据质量守恒定律,装置_____(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果______(选填“偏大”或“偏小”)。