题目内容
【题目】用化学用语填空:
①2个氢原子__________;
②氖气___________;
③水中氧元素为﹣2价____________;
④4个氢氧根离子______________;
⑤地壳中含量最多的金属元素:____________.
【答案】2H Ne ![]() 4OH﹣ Al
4OH﹣ Al
【解析】
解:①子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氢原子可表示为:2H;
②氖气是一种稀有气体单质,由原子直接构成的,其化学式用元素符号来表示,故填:Ne;
③由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故水中氧元素为﹣2价可表示为![]() ;
;
④离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故4个氢氧根离子表示为4OH﹣;
⑤地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,其元素符号为:Al。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
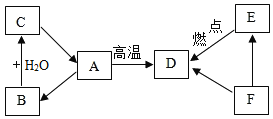
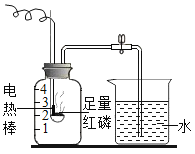
小学生10分钟应用题系列答案【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
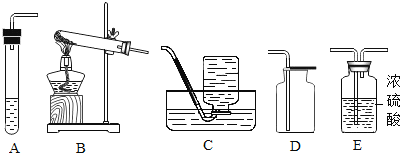
(1)甲同学将课本的基础知识进行整理如上图,请你帮助他完成相关内容.
制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | _________ | ________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是_________(填序号).
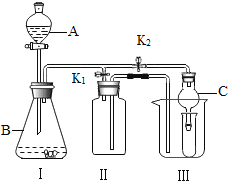
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________。
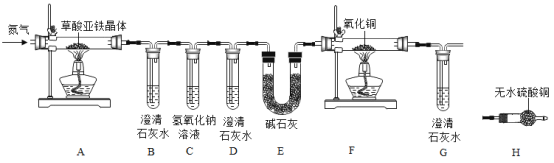
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
操作现象 | 结论 | |
① | 取适量生成物置于试管中, 。 | 生成物中不含碳酸镁。 |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, 观察到 现象。 | 生成物中不含氢氧化镁。 |
;(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 。
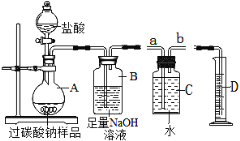
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 ,碳元素的质量分数为 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为 ,装置C的作用为 。判断样品完全反应的方法:当观察到装置B中 ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。 (3分)
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是 。
②分析图像数据判定该说法是 (填“真的”或“假的”),判定理由是 。