题目内容
【题目】(4分)乙炔(![]() )是生产聚氯乙烯的重要原料。用电石(主要成分为
)是生产聚氯乙烯的重要原料。用电石(主要成分为![]() )与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙
)与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙![]() ,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
(1)乙炔中碳、氢元素的质量比为 。
(2)100kg上述电石渣中氢氧化钙的质量为 ![]() 。
。
(3)用上述电石渣处理含硫酸![]() 的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
【答案】(1)12:1 (2)92.5kg (3)160kg
【解析】
试题分析:(1)根据乙炔的化学式C2H2,碳、氢元素的质量比=12×2:1×2=12:1
(2)电石渣中含氢氧化钙92.5%,故100kg电石渣中氢氧化钙的质量=100kg×92.5%=92.5kg
(3)根据化学方程式:Ca(OH)2+H2SO4==CaSO4+2H2O中H2SO4与Ca(OH)2的质量关成,可计算出Ca(OH)2的质量,进一步计算出需要电石渣的质量
解:设需要电石渣中Ca(OH)2的质量为![]()
Ca(OH)2+H2SO4==CaSO4+2H2O
74 98
x 196kg
74:98=x:196kg
x=148kg
需要电石渣的质量=148kg/92.5%=160kg
答:需要电石渣160kg

练习册系列答案
相关题目
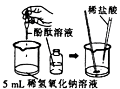
【题目】下列实验方法一定能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 检验一瓶气体是否为 | 将燃着的木条伸入瓶中 |
B | 鉴别 | 分别点燃,在火焰上方罩一干冷烧杯 |
C | 鉴别石灰水和 | 加入适量的稀盐酸 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入 |