题目内容
【题目】化学与人类的生产、生活密切相关。
(1)化学与健康。
钙能强壮骨骼,在人体中属于_____________(填“常量元素”或“微量元素”)。
在人体组织中,葡萄糖(C6H12O6)在酶的催化作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,该反应的方程式为_______________________________________。
(2)化学与资源。
在空气成分中,稀有气体所占比率虽然很小,但有广泛的用途。写出氦气的化学式,并标出氦元素的化合价:_______。
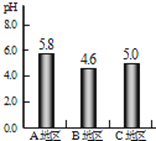
降雨是自然界中水循环的一个环节。正常的雨水略呈______性(填“酸”或“碱”),是由于_________________________(填化学方程式),酸雨是由于SO2等气体或这些气体在空气中反应后的生成物溶于雨水所形成。A、B、C三个地区雨水的pH如图所示,其中________地区的雨水是酸雨。
(3)化学与材料。智能手机是一种多功能通信工具,一款智能手机通常含有41种以上化学元素,请回答:
大部分手机外壳是用塑料或镁合金制成,二者属于高分子合成材料的是___________。
手机线路的主要原料是铜,微电子材料还用到金、银、钽等,在此主要利用了铜的______性。
手机屏幕大部分用的是硅酸铝玻璃,下列关于硅酸铝玻璃性质的推测不正确的是_____(填序号)。
a.透光性好 b.常温下不易与氧气反应 c.易溶于水
【答案】常量元素 C6H12O6+6O2![]() 6CO2+6H2O
6CO2+6H2O ![]() 酸 CO2+H2O=H2CO3 BC 塑料 导电 c
酸 CO2+H2O=H2CO3 BC 塑料 导电 c
【解析】
(1)①钙元素与人体所需的常量元素;
②葡萄糖与氧气在酶的作用下生成二氧化碳和水,反应的方程式为:C6H12O6+6O2![]() 6CO2+6H2O;
6CO2+6H2O;
(2)①氦气是一种稀有气体单质,在单质中元素的化合价为零,可表示为:![]() ;
;
②空气中的二氧化碳与水反应生成碳酸,反应的方程式为:CO2+H2O=H2CO3,所以正常的雨水显酸性,我们把pH<5.6的雨水称为酸雨;
(3)①塑料属于有机高分子材料;镁合金属于金属材料;
②铜具有导电性,所以可用来制电路;
③手机屏幕大部分用的是硅酸铝玻璃,说明硅酸铝玻璃不易溶于水。

【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
(查阅资料) ①人呼出的气体中主要成分是N2.O2.CO2和水蒸气等。
②CO2 + 2NaOH = Na2CO2 + H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)
实验 Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如图1所示。
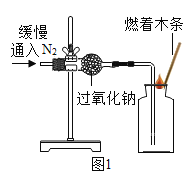
(2)实验现象及结论:观察到_________ 现象 ,判断过氧化钠与氮气没有发生反应。
实验 Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
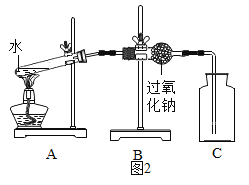
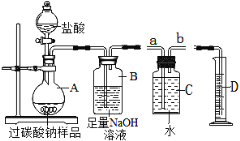
(1)同学们在老师的指导下设计了如图2所示装置。其中A装置的作用是________,发生的变化是______变化。
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验 Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如图3所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)
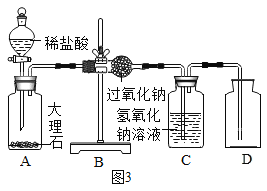
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸 | A装置中观察到的现象有_____,C装置中有气泡出现。 | A装置中发生反应的化学方程式为____; |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是________(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是____________________。
【题目】某实验小组利用废硫酸液制备K2SO4

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液