题目内容
【题目】除去铜粉中混有的少量铁粉,下列方法不可取的是( )
A.将粉末加入足量的稀盐酸中B.将粉末加入足量的硫酸铜溶液中,过滤
C.在空气中充分灼烧D.用磁铁吸引
【答案】D
【解析】
A、将粉末加入足量的稀盐酸中,Fe+2HCl=FeCl2+H2↑铁粉反应完全,剩余固体是铜;故选项正确,但不符合题意。
B、将粉末加入足量的硫酸铜溶液中,Fe+CuSO4=FeSO4+Cu,铁粉反应完全,过滤得到铜;故选项正确,但不符合题意。
C、铜在空气中灼烧:C2u+O2![]() 2CuO;铁丝在氧气中灼燃烧生成铁的氧化物,该操作会将主要物质消耗,故选项错误,但符合题意。
2CuO;铁丝在氧气中灼燃烧生成铁的氧化物,该操作会将主要物质消耗,故选项错误,但符合题意。
D、磁铁可以吸引铁粉,不能吸引铜,能将两种物质分离,故选项正确,但不符合题意。
故选:D。

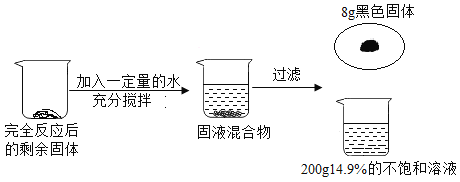
【题目】一种含碳酸钙的“石头纸”越来越流行,为测定碳酸钙的含量,课外活动小组同学称取50g碎纸样品,分别在5只烧杯中进行实验,实验数据见表(假设纸张其他成分既不溶于水,也不与稀盐酸反应)。
烧杯① | 烧杯② | 烧杯③ | 烧示④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | 2.64 | 3.52 | 3.52 |
(1) 10g样品与足量稀盐酸反应最多生成_____g气体;
(2)求样品中碳酸钙的质量分数_____。
【题目】实验室有一瓶常用的无色溶液标签模糊了(如图1)。为确定该瓶溶液的溶质是什么,同学们进行了如下探究。
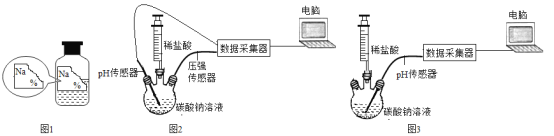
(提出问题)这瓶溶液中的溶质是什么?
(提出猜想)猜想1:可能是氢氧化钠;
猜想2:可能是碳酸氢钠;
猜想3:可能是碳酸钠;
猜想4:可能是氯化钠。
查阅资料)①碳酸氢钠稀溶液显碱性;②碳酸氢钠稀溶液不与氯化钙稀溶液反应。
(实验探究)
实验设计 | 实验现象 | 实验结论 |
小亮同学取2mL该无色溶液于试管中,滴入2滴无色酚酞试液 | 溶液变红 | 猜想1正确,猜想4不正确 |
小丽同学取2mL该无色溶液与试管中,倒入3mL稀盐酸 | 立即产生气泡 | 猜想_____不正确 |
(交流讨论)
(1)同学们一致认为小亮同学的实验结论不严谨,请说出理由:_____。
(2)为确定无色溶液到底是什么,小强同学继续进行了如下实验:
①取2mL该无色溶液于试管中,滴入稀氯化钙溶液,边加边震荡,观察到_____现象。由此得出猜想3正确,请写出该反应的化学方程式:_____。
②另取2mL该无色溶液于试管中,逐滴加入稀盐酸,一段时间后,才观察到有气泡产生。
小丽和小强都是向无色溶液中加入稀盐酸,为什么现象不尽相同呢?
(延伸探究)在老师的指导下,小强和小丽分别用下面的数字化技术分别测量密闭容器中碳酸钠溶液、碳酸氢钠溶液与稀盐酸反应的装置(所用的碳酸钠溶液、碳酸氢钠溶液浓度相同,稀盐酸的浓度也相同)。
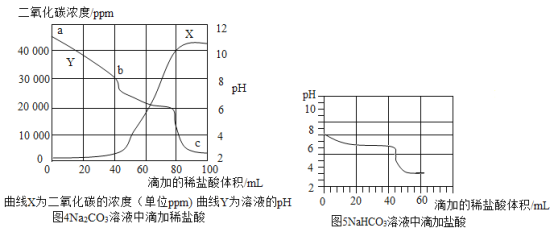
小强和小丽分别从注射器中缓慢滴入盐酸,记录数据。小强用图2装置得到的数据如图4,小丽用图3装置得的数据如图5。
(交流评价)
(3)由图4图5可知,所用两种溶液碱性强的是_____(写化学式)。
(4)c点的溶质是_____。
(5)将图5和图4阴影部分进行叠加,发现两者基本重合,判断b点的溶质是_____和_____。此结论可以解释小强第二次实验开始时无明显气泡产生的原因。
(6)由图4可知,当稀盐酸加至80mL时,Na2CO3恰好完全反应。此时溶液的pH小于7,原因是_____。
【题目】如图是何军同学设计的探究物质燃烧条件的3个对比实验,分析实验:请根据各实验现象,帮助何军同学完成下列实验报告::

步骤 | 设计意图 | 实验现象 | 实验结论 |
实验一 | 燃烧与物质的关系 | ______ | 可燃物才能燃烧 |
实验二 | ______ | 玻璃杯内蜡烛熄灭,外面的仍燃烧 | ______ |
实验三 | 燃烧与温度的关系 | 小木条很快燃烧,小煤块很久才燃烧 | ______ |