题目内容
【题目】现有32g某种铁的氧化物,用足量的CO将其完全反应,将生成的气体通过足量澄清石灰水,得到沉淀50g,则这种铁的氧化物可能是 ( )
A.FeO
B.Fe3O4
C.FeO与Fe3O4的混合物
D.Fe2O3与Fe3O4的混合物
【答案】C
【解析】
设:生成50g碳酸钙,需二氧化碳质量为x。
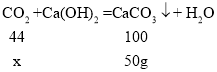
![]() x=22g;
x=22g;
22g二氧化碳中氧元素质量=![]() ;
;
氧化亚铁、氧化铁、四氧化三铁和一氧化碳反应的化学方程式为
FeO+CO![]() Fe+CO2,3CO+ Fe2O3
Fe+CO2,3CO+ Fe2O3![]() 2Fe + 3CO2,Fe3O4+4CO
2Fe + 3CO2,Fe3O4+4CO![]() 3Fe+4CO2,由反应的化学方程式可知,反应生成的二氧化碳中的氧元素一半来自于一氧化碳,一半来自于铁的氧化物,因此铁的氧化物中氧元素质量为16g÷2=8g,32g某种铁的氧化物中氧元素质量分数=
3Fe+4CO2,由反应的化学方程式可知,反应生成的二氧化碳中的氧元素一半来自于一氧化碳,一半来自于铁的氧化物,因此铁的氧化物中氧元素质量为16g÷2=8g,32g某种铁的氧化物中氧元素质量分数=![]() ,氧化亚铁、氧化铁、四氧化三铁中氧元素质量分数分别是:
,氧化亚铁、氧化铁、四氧化三铁中氧元素质量分数分别是:![]() ,由以上计算可知,这种铁的氧化物不可能是FeO、Fe2O3与Fe3O4的混合物、Fe3O4,可能是FeO与Fe3O4的混合物。故选C。
,由以上计算可知,这种铁的氧化物不可能是FeO、Fe2O3与Fe3O4的混合物、Fe3O4,可能是FeO与Fe3O4的混合物。故选C。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目