题目内容
【题目】下列示意图与对应的叙述正确的是
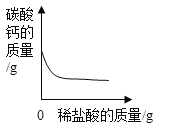
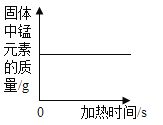
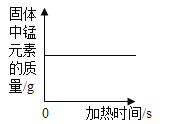
A.向一定量铁粉中滴加稀盐酸 | B.向一定量碳酸钙中加入稀盐酸 | C.加热一定量高锰酸钾固体 | D.向盛有二氧化锰的烧杯中加过氧化氢溶液 |
|
|
|
|
A.AB.BC.CD.D
【答案】CD
【解析】
A、向一定量铁粉中滴加稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,随着反应的进行,氢气质量逐渐增加,且从零开始增加,待铁完全反应后,不再变化,不符合题意;
B、向一定量碳酸钙中加入稀盐酸,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,随着反应的进行,碳酸钙的质量逐渐减小至零,不符合题意;
C、加热一定量高锰酸钾固体,高锰酸钾受热分解为锰酸钾、二氧化锰和氧气,固体中锰元素的质量不变,符合题意;
D、向盛有二氧化锰的烧杯中加过氧化氢溶液,过氧化氢在二氧化锰的催化下分解为水和氧气,二氧化锰是催化剂,化学反应前后,质量不变,故固体中锰元素的质量不变,符合题意。
故选CD。

 名校课堂系列答案
名校课堂系列答案【题目】(1)为测定空气中氧气含量,某小组同学选用40mL的试管作反应容器和量程体积足够大且润滑很好的针筒注射器(如图) ,将足量白磷放入试管后,用橡皮塞塞紧试管,并夹紧弹簧夹。用酒精灯加热白磷,燃烧结束后,待试管冷却后松开弹簧夹,观察现象。
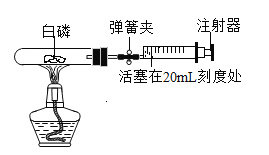
①开始实验前,该小组同学打开弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处。该操作的主要目的是_______。
②实验后,可以观察到针筒活塞会从原来的20mL刻度处慢慢向左移到约__处。
a 4mL刻度
b 8mL刻度
c 12mL刻度
d 16mL刻度
③下列实验操作,对实验结果有影响的是______。
a 装置漏气
b 白磷过量
c 燃烧结束后,立即松开弹簧夹,观察现象
(2)小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料, 记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg( NO3)2 | Mg( OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 |
[初步分析]其他同学认为不可能生成上表中的_____,理由是______。
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的___反应生成的。
[实验探究]小婧设计实验证实了自己猜想。
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:______;___。
[反思与评价]①空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释____。
②通过上述实验,你对燃烧有什么新的认识?_____。
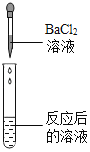
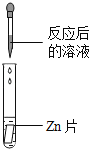
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_____,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液中溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | _____ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH<7 | _____ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的操作错误是_____。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由_____。
(总结提高)依据所给实验用品,设计与上述实验不同的方案,确认猜想三是正确的,请你写出你的实验方案_____。