题目内容
【题目】酸、碱、盐在生产和生活中有广泛的应用。
(1)实验时同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是因为_____。
(2)粗盐中含有少量不溶性杂质(泥沙),还含有少量可溶性杂质(Na2SO4、CaCl2)。现以粗盐为原料制取精盐,除去杂质的操作为: I加水溶解: II 加过量BaCl2溶液; Ⅲ加过量的Na2CO3溶液; IV过滤: V加适量盐酸; VI蒸发结晶。请回答下列问题:
①实验操作步骤IV过滤和VI蒸发结晶都用到的玻璃仪器是_______。
②写出加过量BaCl2溶液时反应的化学方程式_________。
③加入过量Na2CO3溶液的目的是________。
(3)实验室配制一定质量分数的氯化钠溶液时,下列操作会导致溶液的质量分数偏小的是______(填序号)。
①用量筒量取水时仰视读数;
②将配好的溶液倒入试剂瓶中时有少量溅出;
③称量含不溶性杂质的氯化钠来配制溶液;
④所用砝码已生锈。
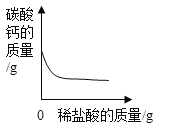
(4)氢氧化钠溶液与盐酸反应时溶液pH的变化如图所示。
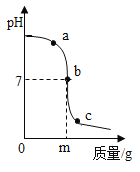
①下列说法正确的是______。
A c点所示溶液为碱性
B用酚酞溶液可以区分a、b、c三点处的溶液
C a点所示溶液中溶质为NaCl和NaOH
D该图所对应操作是将氢氧化钠溶液滴入盐酸中
②若改用mg硫酸与相同量氢氧化钠反应,所得溶液的pH___7(填“>” 、“<”或“=”)。
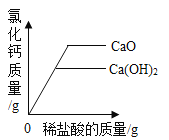
(5)某研究性学习小组对“氯碱工业”生产的烧碱样品中碳酸钠的质量分数进行如下探究:取10g烧碱样品加入到100g 稀盐酸中恰好完全反应,反应后测得溶液的质量为109.78g(气体的溶解忽略不记)。请计算该样品中碳酸钠的质量分数。_____
【答案】瓶口出现白雾的是浓盐酸,因为浓盐酸有挥发性 玻璃棒 ![]() 除去杂质CaCl2和过量的BaCl2 ①、③ C > 5.3%
除去杂质CaCl2和过量的BaCl2 ①、③ C > 5.3%
【解析】
(1)实验时同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是因为瓶口出现白雾的是浓盐酸,因为浓盐酸有挥发性;
(2)①实验操作步骤Ⅳ过滤和Ⅵ蒸发结晶都用到的玻璃仪器是玻璃棒;
②加过量BaCl2溶液时与硫酸钠发生了反应,化学方程式是:![]() ;
;
③由于滤液中含有氯化钙和过量的氯化钡,加入过量Na2CO3溶液的目的是除去杂质CaCl2和过量的BaCl2;
(3)①用量筒量取水时仰视读数,实际量取的水偏多,导致溶液质量偏大,会导致溶液的质量分数偏小;
②溶液具有均一、稳定性,将配好的溶液倒入试剂瓶中时有少量溅出,不会影响溶质的质量分数;
③称量含不溶性杂质的氯化钠来配制溶液,会使溶质质量偏小,会导致溶液的质量分数偏小;
④所用砝码已生锈,称取氯化钠的质量偏多,会导致溶液的质量分数偏大;
故填:①③;
(4)①A、c点所示溶液的pH小于7,溶液为酸性,故A错误;
B、由于图象可知,a、b、c三点处的溶液分别呈碱性、中性和酸性,由于酚酞试液在中性和酸性的溶液不变色,所以用酚酞溶液不可以区分a、b、c三点处的溶液,故选项说法错误;
C、a点所示溶液呈碱性,溶质为NaCl和NaOH,故C正确;
D、图象中pH值的变化是从大于7逐渐的减小到小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故选项说法错误。
故选C;
②中和反应的实质是氢离子和氢氧根离子结合生成了水,若改用mg硫酸与相同量氢氧化钠反应,由于mg硫酸所含的氢离子少,所得溶液呈碱性pH>7;
(5)设烧碱样品中碳酸钠的质量为x,生成CO2的质量为![]() ;
;
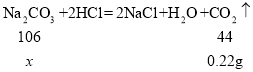
![]()
x=0.53g,
样品中碳酸钠的质量分数为:![]() ,
,
答:样品中碳酸钠的质量分数5.3%。

【题目】2020年我国在部分地区和领域禁塑限塑。化学杜团同学对平常在超市买东西时带回来的塑料袋进行探究。
[查阅资料]日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生;无水氯化钙可用作干燥剂。
探究一、该塑料袋的材料是什么
[实验]小明将该塑料袋样品在氧气中燃烧的产物通入下图一的装置进行探究。
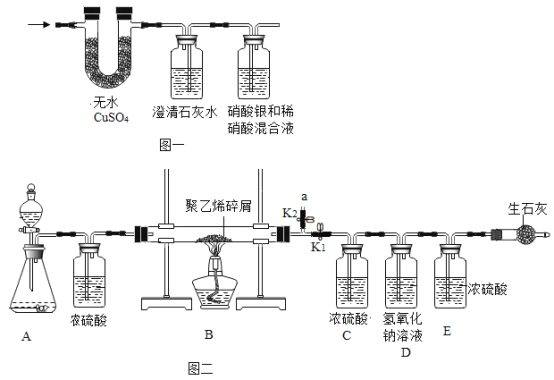
[质疑]李蕾认为小明设计的装置无法得出正确的结论,他的依据是______________。经完善装置,确认该塑料袋的材料是聚乙烯。
探究二、探究聚乙烯的组成碎屑
[实验设计]小组同学设计上图二所示装置。
[分析] A装置是氧气发生装置,反应原理为________________(用化学方程式表示)。
[实验操作]称取5.6g样品碎屑于B处硬质玻璃管中,排出装置中空气后,通入足量的氧气使样品充分燃烧,并将产生的气体通入足量的浓硫酸和氢氧化钠溶液中。
[数据记录]实验结果:
样品燃烧前 | 样品燃烧后 | |
C装置的质量/g | 213.6 | 220.8 |
D. E装置的总质量/g | 440.2 | 457.8 |
[分析与结论]聚乙烯中____________(填“含”或“不含”氧元素,聚乙烯中碳元素,氢元素的质量比为______。
[反思]如果没有E装置,对所测碳元素的质量的影响是___ (填 “偏大”“无影响”或“偏小”)。