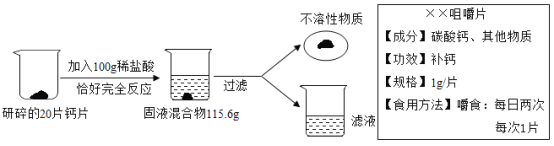
题目内容
【题目】某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
氢氧化钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
沉淀质量/g | 4.9 | 9.8 | m | 19.6 | 19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
【答案】(1)14.7g;(2)14.2%
【解析】
(1)由表中数据可知,第一次加入20g氢氧化钠溶液,产生4.9g沉淀,第二次加入20g氢氧化钠溶液,共产生9.8g沉淀,第四次加入20g氢氧化钠溶液,共产生19.6g沉淀,由此可得出,每加入20g氢氧化钠溶液,产生4.9g沉淀,故m=4.9g×3=14.7g;
(2)由表中数据可知,当加入80g氢氧化钠溶液时,氢氧化钠与硫酸铜恰好完全反应,这时生成氢氧化铜沉淀的质量为19.6g。
设恰好完全反应时,生成硫酸钠的质量为x。
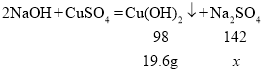
![]() x=28.4g
x=28.4g
恰好完全反应时所得溶液中溶质的质量分数为:![]()
答:恰好完全反应时所得溶液中溶质的质量分数为14.2%。

【题目】绿矾(FeSO4·7H2O)用途广泛,可用作净水剂,医学上可用作补血剂,还可用于制颜料。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的吸附作用,使杂质沉降来达到净水的目的。
(2)缺铁会引起贫血,铁是一种人体必需的微量元素。
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
(4)铁的氧化物中已知三氧化二铁为红色。四氧化三铁和氧化亚铁为黑色。
(5)氢氧化钠溶液可以吸收二氧化硫和三氧化硫;高锰酸钾溶液可以检验二氧化硫。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
(查阅资料)①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。④硫有两种常见的氧化物,部分性质如下表:
硫的氧化物 | 熔点 | 沸点 | 能否使高锰酸钾溶液褪色 |
SO2 | -75.5℃ | -10℃ | 能 |
SO3 | 16.8℃ | 44.8℃ | 不能 |
(提出问题)《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是____________,那么产生的几种气态非金属氧化物是什么呢?
(进行猜想)猜想1:H2O和_____________;
猜想2:H2O和SO3;
猜想3:H2O、SO2和SO3
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是__________________________。
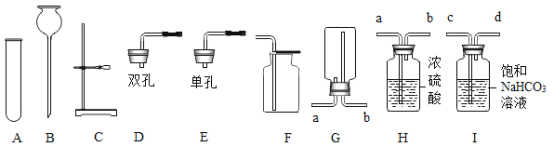
(设计实验)乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:
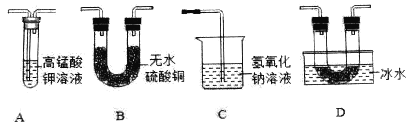
需将绿矾高温分解产生的气体依次通过_____________(填字母,且每套装置限用一次)。
(分析现象)进行上述实验,观察到A中试管内溶液_________,B中U形管内固体__________,D中U形管内出现无色晶体,说明猜想3正确。绿矾高温分解的化学方程式为______________。