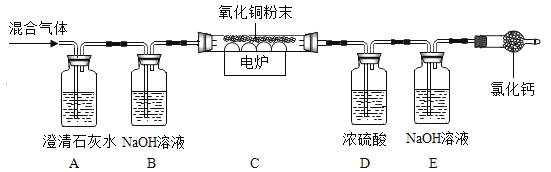
题目内容
【题目】图为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:
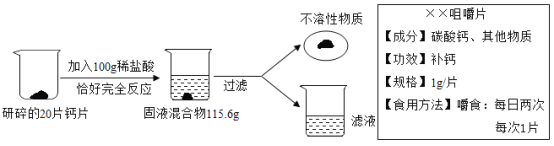
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式_________。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为_________。
(4)钙片中钙元素的质量分数为_______。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为_____。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为_____。
【答案】(1)![]() (2)
(2)![]() (3)20g(4)20%(5)10%(6)80t
(3)20g(4)20%(5)10%(6)80t
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,碳酸钙高温生成氧化钙和二氧化碳。
(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故实验过程中发生反应的化学方程式为![]() 。
。
(2)由质量守恒定律可知,反应前后反应物的总质量等于生成物的总质量,减少的是生成的二氧化碳的质量,则生成的二氧化碳的质量为![]()
设反应的氯化氢的质量为x
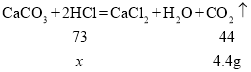
![]()
故所加的稀盐酸中溶质质量(x)的比例式为![]() 。
。
(3)由(2)可知,所加的稀盐酸中溶质质量为7.3g,所加的稀盐酸的溶质质量分数为![]() ,设所需浓盐酸的质量为y,
,设所需浓盐酸的质量为y,![]() ,
,![]() ,故用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为20g。
,故用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为20g。
(4)设碳酸钙的质量为z
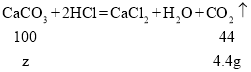
![]()
![]()
钙片中钙元素的质量为![]()
故钙片中钙元素的质量分数为![]() 。
。
(5)滤液的质量为![]() ,
,
设反应生成氯化钙的质量为m
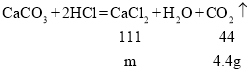
![]()
![]()
故若向滤液中加入5.4g水,所得溶液中溶质的质量分数为![]() 。
。
(6)设生成的氧化钙的质量为n
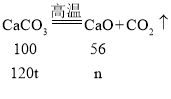
![]()
![]()
故理论上需含氧化钙84%的生石灰的质量为![]() 。
。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
氢氧化钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
沉淀质量/g | 4.9 | 9.8 | m | 19.6 | 19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)