题目内容
【题目】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
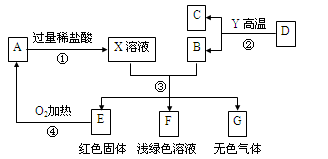
(1)A物质的化学式是____________。
(2)写出反应②的化学方程式:__________________________________。
(3)写出反应③中生成红色固体的化学方程式:______________________________。
【答案】(1)CuO
(2)3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
(3)Fe+CuCl2=FeCl2+Cu
【解析】
试题分析:反应②是炼铁工业中的主要反应,那么是3CO+2Fe2O3![]() 2Fe+3CO2,D和Y分别是Fe2O3和CO,B能与X反应,所以B是Fe,C是CO2;E是红色固体且能与氧气加热反应,产物A能与HCl反应,那么E是Cu,A是CuO,X是CuCl2和HCl的混合物;由上F是FeCl2,G是H2。(1)A是CuO;(2)炼铁工业的反应结合教材即为一氧化碳高温与氧化铁反应生成铁和二氧化碳;(3)Fe与CuCl2的反应。
2Fe+3CO2,D和Y分别是Fe2O3和CO,B能与X反应,所以B是Fe,C是CO2;E是红色固体且能与氧气加热反应,产物A能与HCl反应,那么E是Cu,A是CuO,X是CuCl2和HCl的混合物;由上F是FeCl2,G是H2。(1)A是CuO;(2)炼铁工业的反应结合教材即为一氧化碳高温与氧化铁反应生成铁和二氧化碳;(3)Fe与CuCl2的反应。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目