题目内容
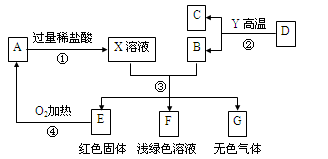
【题目】“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是一种重要的铜矿石原料,受热可分解为三种常见的化合物,物质转化关系如图所示,其中A是最常见的液态物质,B是黑色固体,F、G为金属单质.根据推断回答下列问题.

①H的化学式是________;
②碱式碳酸铜[Cu2(OH)2CO3]中铜元素与氧元素的质量之比为________;
③写出D+F→G+H反应的化学方程式:________;
④向碱式碳酸铜[Cu2(OH)2CO3]中加入足量的盐酸,固体完全溶解,有无色气体生成,写出此反应的化学方程式:________.
【答案】①FeSO4 ②8︰5
③Fe+CuSO4=Cu+FeSO4
④HCl+Cu2(OH)2CO3=2CuCl2+3H2O+CO2↑
【解析】由“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3]可以看出,该物质由Cu、C、H、O四种元素组成,受热分解生成的三种化合物一定包含这四种元素中的两种或多种.其中A是最常见的液态物质,一定是水;B是黑色固体,为氧化铜;B和硫酸反应生成的D为硫酸铜;C能和碳单质反应,则C为CO2,E为CO,CO高温下和Fe2O3反应生成Fe和CO2,F为金属单质,则F是Fe.Fe和CuSO4反应生成的G是金属单质,则G是Cu,H是FeSO4.

【题目】甲、乙两同学在学完酸的化学性质后,做了如下实验:

【观察与讨论1】甲同学在做实验时观察到的明显现象是悬浊液由浑浊变澄清 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:
在碳酸钠溶液中逐滴加入少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,才能观察到有气泡产生,再发生反应的化学方程式为 。
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。据此可以确定,甲同学的试管中废液含有的溶质一定有酚酞、
(写化学式),
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中除酚酞外还含有什么溶质?
【猜想与假设】猜想1:废液中含有CaCl2、NaCl两种溶质。
猜想2:废液中含有 (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
方案 | 方法步骤 | 实验现象 | 实验结论 |
甲同学 | 取少量废液于试管中,向其中滴加盐酸, | 无气泡产生 | 猜想3不正确 |
乙同学实验 | 取少量废液于试管中,向其中加入 | 猜想2正确 |
【表达与交流】甲、乙同学经过实验确认了混合废液中溶质的成分。以下甲乙同学关于废液成分的观点,你赞成的有 。
A.可以加入适量的石灰石或熟石灰对混合废液进行处理后排放
B.取混合废液,滴加少量碳酸钠溶液,则一定能观察到白色沉淀
C.取混合废液,滴加少量硝酸银溶液,则一定能观察到白色沉淀
D.可以用碳酸钠溶液对废液成分中氯化钙的含量进行定量测定