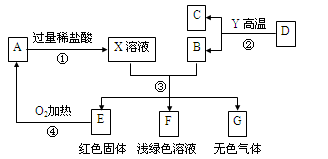
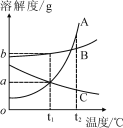
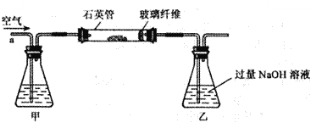
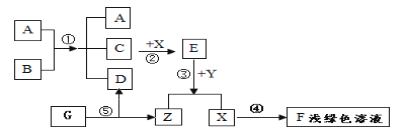题目内容
【题目】(9分)下图是燃气灶示意图。

(1)如图是燃气灶的图片:图片中含有的有机合成材料是 _ _ 。当燃气灶的火焰呈现黄色或橙色,锅底出现黑色,其原因是_ _ __。此时就需要___ _ ___(填“增大”或“减小”)灶具的进风口。
(2)下列两图分别表示1kg不同燃料燃烧产生CO2和SO2的质量。
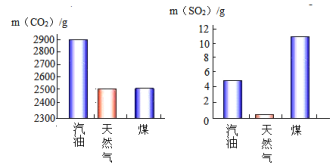
①其中较清洁的燃料是____ __ __,使用____ ___作燃料时最易形成酸雨。
②减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,根据图示回答下列问题。
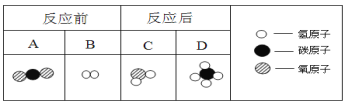
以上4种物质中属于氧化物的是__ (填字母序号);该反应中A、C两种物质的质量比是 。
(3)①图甲是水分子电解模型图,根据质量守恒定律可判断该模型图中缺少了 。
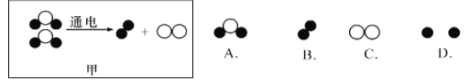
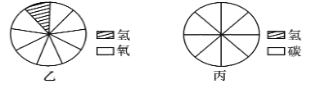
②图乙表示水中各元素质量分数模型,请模仿该图,在图丙中建立甲烷(CH4)中各元素质量分数模型。
【答案】(1)塑料旋钮 燃料燃烧不充分(或空气或氧气不足)。 增大。
(2)①天然气, 煤
②AC(有错或漏一个不得分); 11:9
(3)(1个)B
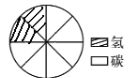
【解析】
试题分析:(1)其中塑料旋钮属于塑料,有机合成材料;锅底出现黑色,说明燃烧产生炭黑,即燃烧不完全;完全燃烧需要充足的氧气,因此要增大;(2) ①天然气燃烧产生的空气污染物二氧化硫是最少的;②A为CO2,B为H2,C为H2O,D为CH4,方程式为CO2+4H2 =2H2O+CH4,属于氧化物的是AC;A、C两种物质的质量比=44×1:18×2=44:36=9:1;(3)根据质量守恒定律,反应前后原子的种类和数目不变,因此选B。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目