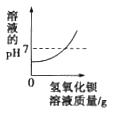
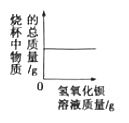
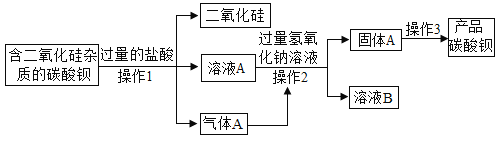
题目内容
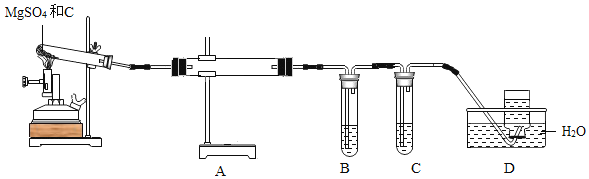
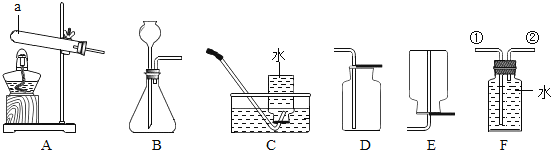
【题目】实验室用KClO3和MnO2制O2,反应后分离KCl和MnO2(难溶于水)。下列图示装置能达到实验目的是( )
A. 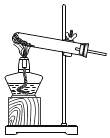 用此装置制取O2B.
用此装置制取O2B. ![]() 用此装置收集O2
用此装置收集O2
C. 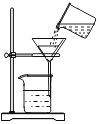 用此装置过滤D.
用此装置过滤D. 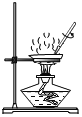 用此装置蒸发滤液
用此装置蒸发滤液
【答案】AD
【解析】
A、实验室用KClO3和MnO2制O2,给试管中的固体加热时,为防止冷凝水回流到热的试管底部,试管口应略向下倾斜,图中所示操作正确,符合题意;
B、氧气的密度比空气的大,应用向上排空气法收集,图中所示操作错误,不符合题意;
C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,图中所示操作错误,不符合题意;
D、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作正确,符合题意。故选AD。

练习册系列答案
相关题目