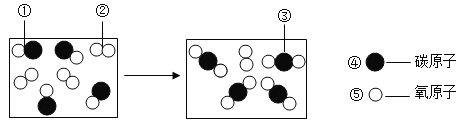
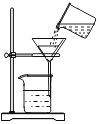
题目内容
【题目】碳酸钡是工业上一种重要的化工产品,以下是某工厂用含二氧化硅杂质的碳酸钡原料来生 产碳酸钡的工艺流程,请你根据流程回答下列问题:
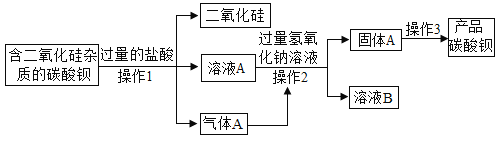
(1)生产流程中为节约成本,生成的气体 A 直接应用于流程中,其气体A是_______
(2)流程中溶液A中含有的溶质成分是________
(3)流程中溶液B中溶质的成分,可能的组合有_________
【答案】二氧化碳或CO2 HCl和BaCl2 NaOH、NaCl;NaOH、NaCl、Na2CO3;NaOH、NaCl、BaCl2
【解析】
(1)碳酸钡能与盐酸反应生成二氧化碳;
(2)碳酸钡能与盐酸反应生成氯化钡,盐酸过量;
(3)反应的化学方程为BaCl2+CO2+2NaOH═BaCO3↓+2NaCl+H2O,溶液中必然存在的溶质是NaOH和NaCl,可能存在Na2CO3和BaCl2二者其中一种。
(1)由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,气体A是二氧化碳;
(2) 由碳酸钡能与盐酸反应生成氯化钡,盐酸过量,流程中溶液A中含有的溶质成分是HCl和BaCl2;
(3)由流程图可知向氯化钡溶液中加入氢氧化钾与二氧化碳,反应后得到碳酸钡沉淀,可知反应的化学方程为BaCl2+CO2+2NaOH═BaCO3↓+2NaCl+H2O,溶液中必然存在的溶质是NaOH和NaCl,可能存在Na2CO3和BaCl2二者其中一种,故可能的组合有NaOH、NaCl;NaOH、NaCl、Na2CO3;NaOH、NaCl、BaCl2。

【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
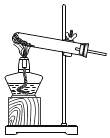
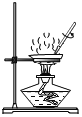
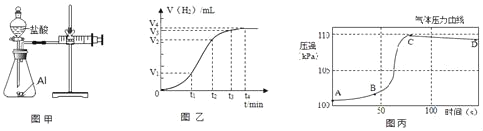
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
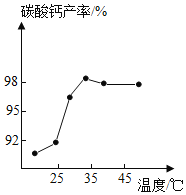
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
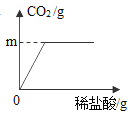
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。