题目内容
【题目】用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
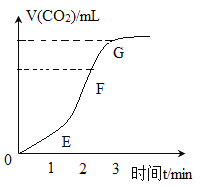
(1)实验过程如图所示,分析判断:_____段化学反应速率最快,FG段反应速率发生变化的主要原因是_____。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_____
A蒸馏水 B氯化钠固体 C氯化钠溶液 D浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?_____
【答案】EF 随着反应的进行,溶液中HCl的质量分数不断减小 AC 改用较大块的碳酸钙固体
【解析】
碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳。
(1)由图示可知:EF段单位时间内生成V(CO2)最多,故EF段化学反应速率最快,FG段反应速率发生变化的主要原因是随着反应的进行,溶液中HCl的质量分数不断减小。
(2)要减缓化学反应速率,需要从影响化学反应速率的各种因素入手:A、C相当于对盐酸进行稀释,使得盐酸的浓度减小,能够减缓反应速率,D中相当于增大盐酸浓度,反应速率加快;加入NaCl固体对化学反应速率影响不大,故可行的是AC。
(3)减小反应物的接触面积,可减缓化学反应速率,故除了上述方法外,减缓化学反应速率可以改用较大块的碳酸钙固体。

【题目】现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4═CuSO4+H2O)试回答下列问题:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
(1)上述表格中m的值为_____,10g样品中CuO的质量为______g.
(2)计算所加入稀硫酸中溶质的质量分数_______?
(3)计算最后所得溶液中硫酸铜的质量分数_________(精确到0.1%)
【题目】小明同学对所学部分化学知识归纳如下,其中正确的是
A | 须辨清的物质 | B | 初中化学中常见的“三” |
干冰不是冰——而是固体CO2 纯碱不是碱——而是盐 水银不是银——而是汞 | 三种可燃性气体——CO、H2、N2 三种有毒物质——CO、亚硝酸钠、H2 三种基本粒子——原子、分子、离子 | ||
C | 化学巨匠及其杰出贡献 | D | 符号中数字“2”的意义 |
张青莲——测量相对原子质量 拉瓦锡——测定空气的组成 侯德榜——发明联合制碱法 | 2O:两个氧分子
O2:两个氧原子 |
A.AB.BC.CD.D