题目内容
【题目】某化学学习小组在探究浓硫酸的化学性质时,将浓硫酸滴加到氯化钠固体中并小心的加热,发现有刺激性气味的气体产生,同时有白雾出现。经查阅资料了解到浓硫酸与氯化钠固体在加热时会发生反应,生成氯化氢(HCl)气体,写出该反应的化学方程式:_________。该兴趣小组对产生的氯化氢气体是否显酸性进行了相关探究。
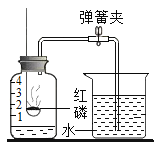
(进行实验)同学们根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:

(实验现象)I和II中小花不变色;III中小花变红色。
(查阅资料)图2是同学们查阅的氯化氢气体溶于水的示意图。
(实验结论)氯化氢气体不显酸性。
(反思交流)
(1)紫甘蓝的汁液在酸性溶液中显_______色;
(2)小明向实验III中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式_________________;
(3)从微观角度分析氯化氢气体不显酸性的原因是___________;
(拓展应用)同学们为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的棉花,做了如图所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端。
(1)白色烟环偏向蘸有浓盐酸的棉花一端,说明在同温同压下,相对分子质量越大的气体,其分子的运动速率越________;(填“大”或“小”)
(2)写出生成白烟的化学方程式_______________。
【答案】H2SO4+2NaCl![]() Na2SO4+2HCl↑ 红 NaOH+HCl=H2O+NaCl 氯化氢气体中不含氢离子 小 NH3+HCl=NH4Cl
Na2SO4+2HCl↑ 红 NaOH+HCl=H2O+NaCl 氯化氢气体中不含氢离子 小 NH3+HCl=NH4Cl
【解析】
浓硫酸与氯化钠固体在加热条件下生成氯化氢(HCl)气体的化学方程式为:H2SO4+2NaCl![]() Na2SO4+2HCl↑,故填:H2SO4+2NaCl
Na2SO4+2HCl↑,故填:H2SO4+2NaCl![]() Na2SO4+2HCl↑。
Na2SO4+2HCl↑。
[实验结论]
氯化氢气体不显酸性。
[反思交流]
(1)氯化氢气体溶于水显酸性,使紫甘蓝的汁液显红色,故填:红;
(2)氢氧化钠与稀盐酸反应的化学方程式为:NaOH+HCl=H2O+NaCl,故填:NaOH+HCl==H2O+NaCl;
(3)氯化氢气体不显酸性的原因是氯化氢气体中不含氢离子,故填:氯化氢气体中不含氢离子;
[拓展应用]
(1)浓氨水挥发出的是NH3气体,浓盐酸挥发出的使HCl气体,NH3的相对分子质量比HCl小,白色烟环偏向蘸有浓盐酸的棉花一端,说明HCl运动速率小,故填:小;
(2)NH3与HCl反应的化学方程式为:NH3+HCl=NH4Cl,故填:NH3+HCl=NH4Cl。

【题目】化学小组用排水法收集了呼出气体,通过(实验1)比较吸入空气和呼出气体的成分差异。
(实验1)
序号 | 实验目的 | 实验操作 | 实验现象 |
① | 比较空气和呼出气体中二氧化碳的含量 | 向呼出气体中倒入少量澄清石灰水,振荡 | _____ |
② | 比较空气和呼出气体中氧气的含量 | 分别将燃着的木条伸入空气和呼出气体中 | 空气中的木条无明显变化,呼出气体中的木条熄灭 |
③ | _____ | 取两块干燥玻璃片,对着其中一块哈气 | 哈气的玻璃片上出现无色液滴,另一块无明显变化 |
(1)实验①的现象为_____,证明呼吸过程中发生了_____(“物理”或“化学”)变化。
(2)实验③的目的是_____。
(3)小明指出实验①不能比较空气和呼出气体中CO2的含量,还需补充的实验操作为_____。小芳对②中燃着木条熄灭的原因提出猜想,并设计(实验2)进行验证。
(猜想与假设)
猜想1:木条熄灭是因为呼出气体比吸入空气中CO2的含量高。
猜想2:木条熄灭是因为呼出气体比吸入空气中O2的含量低。
(实验2)
序号 | ① | ② | ③ | ④ |
实验操作 |
空气 |
O2和CO2体积比 |
O2和N2体积比 |
O2和N2体积比 |
实验现象 | 燃着的木条无明显变化 | 燃着的木条无明显变化 | 燃着的木条熄灭 | 燃着的木条熄灭 |
(4)由实验①和②可得出猜想1_____(填“成立”或“不成立”)。
(5)(实验2)中,能证明猜想2成立的实验序号是_____。
(实验反思)
(6)根据以上实验,下列说法正确的是_____(填字母序号)。
A 吸入空气和呼出气体中O2和CO2的含量不同
B 将燃着木条伸入呼出气体中,木条熄灭,说明呼出气体中没有O2
C (实验1)的②中,燃着木条熄灭的原因还可能与水蒸气含量增多有关
D 若把燃着木条伸入体积比为1:1的O2和CO2混合气体中,会观察到无明显变化