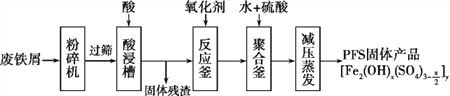
题目内容
【题目】在KMnO4溶液中加入双氧水,振荡、静置,再滴入酚酞,出现如图所示现象。
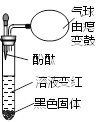
(1)将混合物进行过滤,向滤渣中加入双氧水,迅速产生大量气泡,滤渣的作用是_____。
(2)写出KMnO4溶液与双氧水反应的化学方程式(其中KMnO4与H2O2的化学计量数为2和3)______。
【答案】 催化作用 2KMnO4 + 3H2O2 = 2KOH + 2MnO2↓ + 3O2↑+2H2O
【解析】(1) 能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂,催化剂的作用叫催化作用。将混合物进行过滤,向滤渣中加入双氧水,迅速产生大量气泡,可知滤渣在过氧化氢分解中做催化剂,滤渣的作用是催化作用。(2)据质量守恒定律可知,反应前后原子的种类、个数不变,反应中KMnO4与H2O2的化学计量数为2和3,可知KMnO4溶液与双氧水反应的化学方程式:2KMnO4 + 3H2O2 = 2KOH + 2MnO2↓ + 3O2↑+2H2O。

练习册系列答案
相关题目
【题目】H7N9型禽流感病毒近期在国内某些地区蔓延,引起人们的恐慌与担忧。某市农委立即对该市场活禽进行扑杀,并采取消毒处理。表中所列为某消毒液产品的部分说明书,请根据下表用化学用语填空:
用途 | 杀菌消毒 |
主要成分 | 硝酸、硝酸银、过氧化氢 |
pH | 1.2 |
(1)该消毒液的溶剂是_______;
(2)该消毒液中含有的金属离子是________;
(3)标出硝酸中原子团的化合价__________;
(4)该消毒液久置空气中某成分容易发生分解反应,造成杀毒效果减弱。其反应方程式为__________________________________。