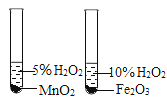题目内容
【题目】为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如图甲所示实验,实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,如图乙所示,则有( )
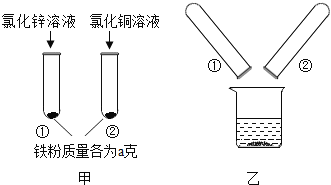
A.甲图试管①中反应后固体可能不含铁
B.甲图试管②中反应后固体可能含铁
C.反应后烧杯中的固体一定含有铁
D.烧杯中最后所得固体的质量一定大于2a g
【答案】D
【解析】
由于三种的金属的活动性顺序是锌>铁>铜,所以甲中铁不会与氯化锌反应,乙中铁会置换出氯化铜中的铜,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,说明铁又会置换出氯化铜中的铜,所以:
A、由于甲中铁不会与氯化锌反应,所以甲图试管①中反应后固体一定含铁,故A错误;
B、由上述分析可知,甲图试管②中反应后的固体一定不含铁,故B错误;
C、通过上面的分析可知,铁会置换出氯化铜中的铜,但是氯化铜的量不能确定,所以反应后烧杯中的固体中是否含铁,不能确定,故C错误;
D、通过题中的分析可知,加入铁的质量是2a,每56份质量的铁会置换出64份质量的铜,所以反应后固体的质量大于2a克,故D正确。故选D。

练习册系列答案
相关题目
【题目】实验设计能实现其对应的实验目的是
|
|
|
|
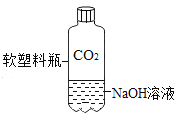
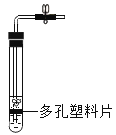
A. 测定空气中O2 的含量 | B. 证明 CO2 与NaOH溶液反应 | C. 比较 MnO2 和Fe2O3 的催化效果 | D. 此装置具有“启普发生器”的功能 |
A.AB.BC.CD.D