题目内容
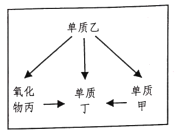
【题目】如图所示,“一”表示相连的两物质可发生反应,“→”表示可以向箭头所指方向一步转化,部分反应物、生成物均已略去;所涉及的物质和反应在初中化学中均较常见,且A、B、E为黑色固体,A、C为单质,其余为氧化物,请回答下列问题:

(1)D物质的化学式:_____;
(2)F→G的化学方程式:_____。
【答案】H2O 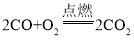
【解析】
A为黑色固体单质,可推测A为碳单质,F、G是可以由A反应得到的氧化物,推测F为一氧化碳或二氧化碳,G为二氧化碳或一氧化碳;A和E可以互相反应,E可以生成二氧化碳或一氧化碳,且E为黑色固体氧化物,推测E为氧化铜,E能生成G,则G为二氧化碳,E为一氧化碳;B为黑色固体氧化物,推测B为氧化铁,B反应得到D,推测D为水,B和酸反应得到D;D可以得到单质C,且A和C可以反应,推测C为氧气;代入关系图中检验可知推测正确。
(1)D物质为水,化学式为H2O;
(2)F为一氧化碳,G为二氧化碳,F→G表示一氧化碳转化为二氧化碳,化学方程式为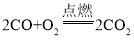 。
。

 阅读快车系列答案
阅读快车系列答案【题目】以下4个图象,能正确反映对应关系的是( )
A | B | C | D |
|
|
|
|
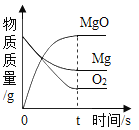
镁在足量氧气中燃烧 | 加热 定质量高锰酸钾固体 | 等质量的镁、锌、 铝与足量等浓度的盐酸分别反应 | 酒精和过量的氧气在密闭容器中完全反应 |
A.AB.BC.CD.D
【题目】电影《我和我的祖国》中有这样一则片段:开国大典前夜, 升旗试验出了问题,旗杆顶部的阻断球因锈蚀变脆而折断,为保证当天升 旗成功,采用焊接方式换上新的不锈钢阻断球,最终升旗仪式完美无缺。

(一)阻断球是常见的铁制品,工业上常用设备高炉来炼铁,主要原料是 焦炭、赤铁矿石(主要含 Fe2O3)、石灰石、空气等,主要反应过程如下:

请回答:
(1)将炼出的“铁”加足量盐酸,充分反应后,总有黑色物质剩余,该黑色物质为________填 化学式);
(2)反应②的化学方程式为_____,该反应所属的基本反应类型为_____。
(二)金属的锈蚀及防护
(1)铁质阻断球的生锈,实际上是铁与_______、_____________共同作用的结果。铁锈的颜色是______;下列情况下铁制品最易生锈的是______(填序号).
a 潮湿空气中 b 干燥空气中 c 部分浸入食盐水中
(2)生活中的铁制品琳琅满目,铁还可以作铁锅利用了铁的_______性,请写出一种生活中防止铁锅生锈的方法:_______。
(3)金属铝比铁活泼,却具有很好的抗腐蚀性,原因是_____________ (用方程式表示)
(三)铁锈组成分析测定
(查阅资料)铁锈成分复杂,化学式可简单表示为 Fe2O3nH2O,在加热时会分步反应,首 先失去结晶水,其反应可表示为 Fe2O3nH2O![]() Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3nH2O)中 n 的值等于多少呢?
(问题探究)为了探究铁锈(Fe2O3nH2O)的组成,称取 30.0g 部分生锈的铁粉样品,样品中仅含铁和 Fe2O3nH2O,按如图 2 所示装置进行实验。
(1)为了保证实验安全,实验开始时应先通 CO,目的是_______;
(2)反应结束后还需持续通 CO,除了防止铁氧化以外,还有_______ 的目的。
(3)实验结束后,A 中玻璃管内出现的现象是_______ ;
(4)请指出该装置中有一处明显不足_______ ;
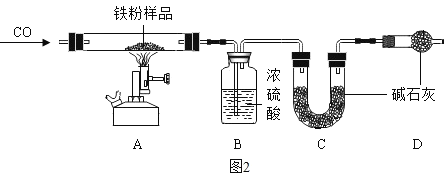
(数据处理)图 3 是加热时间和 A 中固体质量关系图象,下表是 B、C 中质量不再变化时 B中浓硫酸、C 中碱石灰装置质量变化情况。
反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150.0 | 163.2 |
(5)完全反应产生的二氧化碳质量为_______ ;铁锈(Fe2O3nH2O)中 n 的值是______;
(6)写出 T3-T4 时间段所发生的化学方程式_______
(7)计算 30g 样品中单质铁的质量分数_______。(写出计算过程,结果保留到 0.1%)
【题目】在一密闭容积中加入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测出有关数据如下所示,则关于此反应的认识正确的是( )
物质 | X | Y | Z | Q |
反应前质量/g | 20 | 2 | 1 | 37 |
反应后质量/g | 15 | 32 | 1 | 未知 |
A.物质Y一定是单质
B.反应后物质Q的质量为12g
C.反应过程中X和Q的质量比为5:4
D.物质Z一定是该反应的催化剂
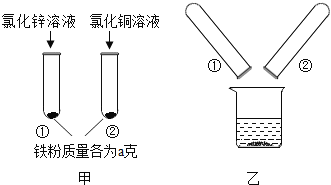
【题目】请你一起参与完成以下两个实验.
[实验一]探究“锡纸”中金属的成分:“锡纸”中的金属是锡吗?
[查阅资料]
①“锡纸”是锡箔或铝箔和纸黏合而成;
②锌粉是一种深灰色固体;
③锡(Sn)与酸或金属化合物溶液反应生成+2价的锡的化合物。
[提出猜想]
猜想I:“锡纸”中的金属是锡;
猜想II:“锡纸”中的金属是铝。
[进行实验]设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想_______(选填“Ⅰ”或“Ⅱ”)成立;反应的化学方程式为________; |
[交流讨论]
① 实验中打磨“锡纸”的目的是__________;
②下列物质的溶液可以替代氯化锌溶液完成上述实验的是_________.(填序号)
A 氯化铜
B 硫酸亚铁
C 硫酸钠
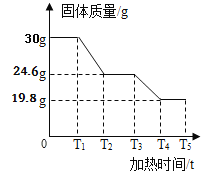
[实验二]甲、乙两位同学利用图中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动.
[实验分析]
(1)请你仿照示例,完成实验现象的记录和分析
实验现象 | 是否遵循质量守恒定律 | |
甲同学 | 白磷_________;气球_______;托盘天平_________; | 该反应遵守质量守恒定律 |
乙同学 | 烧杯内有气泡产生,反应前后托盘天平不平衡 | 该反应不遵守质量守恒定律 |
通过对上述实验的对比分析,你认为_______; (填“甲”或“乙”)的结论是错误的.在实验操作完全正确的情况下,请分析实验结论错误的原因________;
[实验结论]化学反应都遵守质量守恒定律。
[实验反思](2)请从微观角度分析化学反应遵守质量守恒定律的原因是________。