题目内容
【题目】为确定某变质的烧碱样品的变质情况,某化学小组进行了如图1实验:
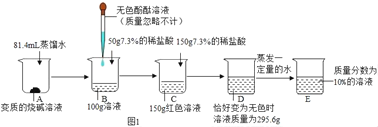
(1)B中加入稀盐酸后发生反应的化学方程式为_____;
(2)根据已知条件列出求解样品中碳酸钠的质量(x)的比例式为_____;
(3)由D﹣E蒸发水的质量为_____g;
(4)样品中未变质的烧碱占变质前原烧碱的质量分数为_____;
(5)提纯上述变质的烧碱样品需要①_____(填一种固体)的质量为②_____;
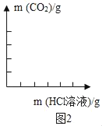
(6)请绘制加入稀盐酸与生成气体质量关系的曲线图____。
【答案】NaOH+HCl=NaCl+H2O 、Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑; ![]() 61.6g 50% 氢氧化钙 7.4g
61.6g 50% 氢氧化钙 7.4g 
【解析】
(1)氢氧化钠变质的反应是氢氧化钠和二氧化碳反应生成碳酸钠和水,100g溶液B中加入50g稀盐酸后,得150g溶液说明该段反应为氢氧化钠和盐酸反应生成氯化钠和水,继续加入150g稀盐酸后,得溶液295.6g,说明发生了碳酸钠和盐酸反应,生成氯化钠、二氧化碳、水,发生反应的化学方程式为NaOH+HCl=NaCl+H2O 、Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑;
(2)根据已知条件可知生成二氧化碳的质量为150g+150g-295.6g=4.4g,设样品中碳酸钠的质量为x。
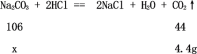
![]() ;
;
(3)设碳酸钠反应生成氯化钠的质量为y,反应的氯化氢的质量为m。
![]()
![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
![]() m=7.3g
m=7.3g
与氢氧化钠反应的氯化氢质量为:200g×7.3%-7.3g=7.3g
则与氢氧化钠反应生成氯化钠的质量也是11.7g
10%的氯化钠溶液的质量为11.7g×2÷10%=234g
由D—E蒸发水的质量为295.6g -234g=61.6g
(4)设样品中氢氧化钠的质量为n。

![]() n=8g
n=8g
设变质的氢氧化钠的质量为a。
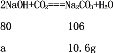
![]() a=8g
a=8g
原氢氧化钠的总质量为8g+8g=16g
样品中未变质的烧碱占变质前原烧碱的质量分数为![]() ×100%=50%
×100%=50%
(5)氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,设提纯上述变质的烧碱样品需要氢氧化钙的质量为b。
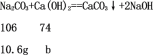
![]()
b=7.4g

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。化学小组的同学从草木灰中提取钾盐,并检验其部分成分。请根据部分盐溶解性表和学过的知识回答下列问题:
部分盐的溶解性表(室温)
阴离子/阳离子 | NO3﹣ | Cl﹣ | SO42﹣ | CO32﹣ |
K+ | 溶 | 溶 | 不 | 溶 |
Ba2+ | 溶 | 溶 | 不 | 不 |
Ca2+ | 溶 | 溶 | 微 | 不 |
Ag+ | 溶 | 不 | 微 | 不 |
实验一:分离提纯
①取适量草木灰样品,研碎。
②将研碎的草木灰样品置于烧杯中,加入适量的蒸馏水溶解。
③过滤
④蒸发结晶。将滤液加入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌。
步骤③过滤需要的玻璃仪器有_____;
步骤④中,用玻璃棒搅拌的目的是_____。
实验二:验证成分
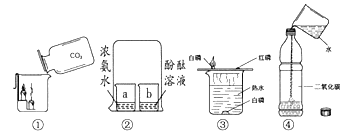
(1)验证碳酸钾存在:取少量实验一所得的晶体置于烧瓶中,按如图所示的装置实验,则试管中装的药品是_____,证明晶体中含有碳酸钾的实验现象是_____。烧瓶中发生反应的化学方程式是_____。
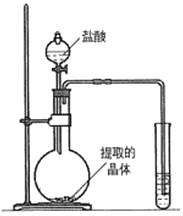
(2)验证硫酸钾存在:
甲同学取少量实验一所得的晶体于试管中,加蒸馏水溶解后,再加入氯化钡溶液,产生白色沉淀,于是他得出晶体中含有硫酸钾的结论。
乙同学认为,甲同学的方案不合理,其理由是:_____。
乙同学继续向甲同学所得白色沉淀中加入过量的_____,观察到_____,证明了晶体中硫酸钾的存在。
【题目】不同温度下,碳酸钠和碳酸氢钠的溶解度如下表所示
温度/℃ 溶解度/g | 0 | 20 | 40 | 60 |
碳酸钠 | 7.0 | 21.8 | 48.8 | 46.4 |
碳酸氢钠 | 6.9 | 9.6 | 12.7 | 16.4 |
⑴ 服用碳酸氢钠治疗胃酸过多时,胃液的pH________(填“增大”、“减小”或“不变”),发生反应的化学方程式是____________________。
⑵为区分碳酸钠和碳酸氢钠两种白色固体。在20℃时,各盛有100mL水的甲、乙两烧杯中,分别加入等质量的碳酸钠和碳酸氢钠固体,充分溶解后,现象如图所示。

甲烧杯中加入的物质是________(填化学式),加入的质量m的范围为:______________。