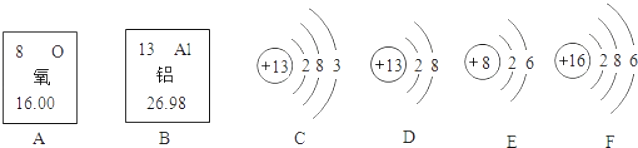
题目内容
【题目】探究影响过氧化氢分解速率的影响因素。
(査阅资料)常温下,H2O2较稳定不易分解;CuSO4溶液、FeCl3溶液和红砖粉末等都能作为H2O2分解制取O2的催化剂。
(分析交流)写出实验室用H2O2溶液和MnO2制取O2的化学方程式:_____。
(实验设计)取相同体积的过氧化氢溶液分别进行下列实验。
实验编号 | 温度/℃ | 催化剂 | 过氧化氢浓度/% |
① | 20 | 无 | 2 |
② | 20 | 无 | 5 |
③ | 20 | 5滴FeCl3溶液 | 5 |
④ | 20 | 5滴CuSO4溶液 | 5 |
(1)实验①②探究的是_____。要探究CuSO4溶液能否做H2O2分解的催化剂,应选择的实验编号是_____。
(2)要定性比较两种催化剂的催化效果,可通过观察_____来实现。要定量比较两者的催化效果,可测量生成等体积气体所需的_____。
(3)同学们实验时还观察到,在H2O2溶液内滴入FeCl3溶液,溶液逐渐由黄色变为浅绿色,最终变回浅黄色。查阅资料得知:FeCl3溶液一般呈黄色,FeCl2溶液一般呈浅绿色。由此你对催化剂有何新的认识?_____。
【答案】![]() 浓度对过氧化氢分解速率的影响 ②④ 产生气泡的快慢 时间 催化剂在化学反应过程中可能参加了化学反应,但是在反应前后催化剂的质量和化学性质均不会发生改变
浓度对过氧化氢分解速率的影响 ②④ 产生气泡的快慢 时间 催化剂在化学反应过程中可能参加了化学反应,但是在反应前后催化剂的质量和化学性质均不会发生改变
【解析】
[分析交流]过氧化氢在二氧化锰的催化作用下分解为水和氧气,化学方程式为:![]() ;
;
[实验设计](1)实验①②中过氧化氢溶液的浓度不同,其他条件相同,所以是探究浓度对过氧化氢分解速率的影响;要探究CuSO4溶液能否做H2O2分解的催化剂,要选择除催化剂不同,其他条件完全相同的两个实验,即实验②和实验④;
(2)要定性比较两种催化剂的催化效果,可通过观察产生气泡的快慢来实现。要定量比较两者的催化效果,可测量生成等体积气体所需的时间;
(3)由题干中的实验现象可知催化剂在化学反应过程中可能参加了化学反应,但是在反应前后催化剂的质量和化学性质均不会发生改变。

 阅读快车系列答案
阅读快车系列答案【题目】今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。我们对此气体展开了一系列探究:
①此气体是什么物质?验证它的实验方案如下:
猜想 | 实验步骤 | 现象及结论 |
此气体可能是:_____ | _____ | _____ |
②产生此气体的化学方程式可能是_____。
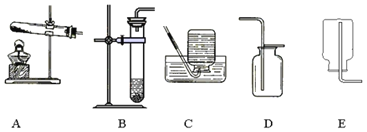
③我想制取该气体,采用的发生装置可选取如图中的_____(填序号),收集装置是_____。