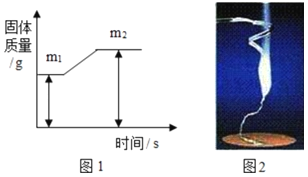
题目内容
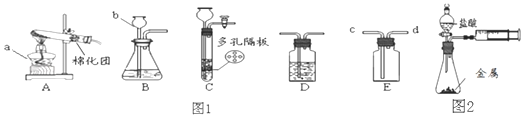
【题目】请结合图示实验装置,回答下列问题。

(1)写出有标号的仪器名称:①_____。
(2)用高锰酸钾制氧气选用的发生装置是_____(选填序号),反应的化学方程式为_____。
(3)若用B装置制取O2.要获得干燥的O2,应先将气体通过盛有_____的D装置,再用E装置收集,气体应从_____端通入(选填“a”或“b”)。
(4)实验室可用B或C装置制CO2,反应的化学方程式为_____,C相对于B装置的优点有_____。
(5)若用F装置收集CO2,油层的作用是_____。
【答案】酒精灯 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 浓硫酸 b CaCO3+2HCl═CaCl2+H2O+CO2↑ 可以控制反应的发生和停止 防止二氧化碳溶于水并与水发生反应
K2MnO4+MnO2+O2↑ 浓硫酸 b CaCO3+2HCl═CaCl2+H2O+CO2↑ 可以控制反应的发生和停止 防止二氧化碳溶于水并与水发生反应
【解析】
(1)标号①的仪器名称为酒精灯;
(2)用高锰酸钾制氧气时,反应物的状态是固体,反应条件是加热,可选用发生装置是A;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)浓硫酸具有吸水性,氧气可以用浓硫酸干燥;氧气的密度比空气大,用E装置收集,气体应从b(长)管进入;
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,大理石或石灰石主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;在装置C中,固体药品物放在多孔隔板上,液体药品从长颈漏斗中加入。关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。实验室常用装置C代替装置B制取气体,装置C的优点是可以随时控制反应的发生与停止;
(5)若用F装置收集CO2,油层的作用是:防止二氧化碳溶于水并与水发生反应。

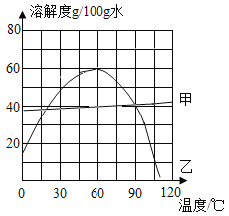
【题目】探究影响过氧化氢分解速率的影响因素。
(査阅资料)常温下,H2O2较稳定不易分解;CuSO4溶液、FeCl3溶液和红砖粉末等都能作为H2O2分解制取O2的催化剂。
(分析交流)写出实验室用H2O2溶液和MnO2制取O2的化学方程式:_____。
(实验设计)取相同体积的过氧化氢溶液分别进行下列实验。
实验编号 | 温度/℃ | 催化剂 | 过氧化氢浓度/% |
① | 20 | 无 | 2 |
② | 20 | 无 | 5 |
③ | 20 | 5滴FeCl3溶液 | 5 |
④ | 20 | 5滴CuSO4溶液 | 5 |
(1)实验①②探究的是_____。要探究CuSO4溶液能否做H2O2分解的催化剂,应选择的实验编号是_____。
(2)要定性比较两种催化剂的催化效果,可通过观察_____来实现。要定量比较两者的催化效果,可测量生成等体积气体所需的_____。
(3)同学们实验时还观察到,在H2O2溶液内滴入FeCl3溶液,溶液逐渐由黄色变为浅绿色,最终变回浅黄色。查阅资料得知:FeCl3溶液一般呈黄色,FeCl2溶液一般呈浅绿色。由此你对催化剂有何新的认识?_____。
【题目】除去下列物质中的杂质所选用的试剂及操作方法中不正确的一组是![]()
![]()
物质 | 所含杂质 | 除去杂质的方法 | |
A |
|
| 将气体缓缓通过灼热的铜网 |
B | NaCl溶液 |
| 过量的稀盐酸 |
C |
| KCl | 溶解、过滤、蒸发结晶 |
D | Cu | CuO | 加足量稀硫酸、过滤 |
A. AB. BC. CD. D