题目内容
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g.请回答下列问题:
(1)二氧化锰在反应中的作用是 。
(2)计算该过氧化氢溶液中溶质的质量分数。(请列式计算)
(3)现要配制100g溶质质量分数为3%的过氧化氢消毒液,需10%过氧化氢溶液的质量为 g。
(1)催化作用; (2)过氧化氢溶液中溶质的质量分数8.5%;(3)30
解析试题分析:(1)根据催化剂的作用分析。反应前后二氧化锰的质量和化学性质都没改变,二氧化锰为反应的催化剂,反应中起催化作用;
(2)根据过氧化氢分解的方程式及质量守恒定律,求出生成的氧气的质量,由氧气的质量求出过氧化氢溶液中溶质质量,再求出溶质的质量分数。生成O2的质量=20g+0.5g﹣19.7g=0.8g,
设该过氧化氢溶液中溶质的质量为x
2H2O2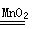 2H2O+O2↑
2H2O+O2↑
68 32
x 0.8g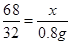
解得:x=1.7g
该溶液中溶质的质量分数为: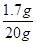 ×100%=8.5%;
×100%=8.5%;
(3)根据溶质质量不变进行计算。根据加水稀释前后溶质质量不变,需10%溶液的质量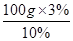 =30g
=30g
考点:考查根据化学反应方程式的计算;有关溶质质量分数的简单计算

练习册系列答案
相关题目
 3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)