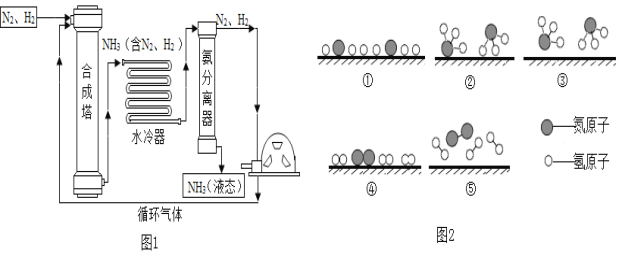
��Ŀ����
����Ŀ��ȡ����غͶ������̵Ļ����30g������һ��ʱ�����ȴ����ȴ��Ƶ�ʣ���������Ϊ20.4g����ʣ��������һ������ˮ�У���ֽ������ˣ��õ���������ϴ�ӡ���ɺ����Ϊ1.5g�����㣺�����ݻ�ѧ����ʽ��ʽ���㣩
��1����������______________mol��
��2����Ӧ��ʣ�����ijɷּ���Ӧ������__________________��
��3��������ء��������̡�������صĻ����װ���Թܲ���ּ��ȣ���Ӧ��ɺ��Թ��в�����������___________________��
��4����A��B��C��10g�Ļ������Ⱥ�Aȫ���μӷ�Ӧ������4gD��ͬʱ������8gC����Ӧ��A��B����������__________________��
���𰸡�0.3 ʣ�������ص�����Ϊ4g�����ɵ��Ȼ���Ϊ14.9g����������1.5g �Ȼ��ء��������̺������ 5��1
��������
��1�����������غ㶨�ɿɵã����ɵ�����������Ϊ30g��20.4g��9.6g�����������ʵ�����32g/mol����9.6g���������ʵ���Ϊ0.3mol��
��2����ֽ������ص�����Ϊx�����ɵ��Ȼ��ص�����Ϊy

![]()
x��24.5g
y��14.9g
��ʣ�������ص�����Ϊ30g��24.5g��1.5g��4g��������������1.5g�����ԣ�ʣ������������ء��������̡��Ȼ��أ�ʣ�������ص�����Ϊ4g�����ɵ��Ȼ���Ϊ14.9g����������1.5g��
��3������ء��������̡�������صĻ������ȣ�����طֽ������Ȼ��غ�����������������ȷֽ���������ء��������̺������������������Ȳ��ֽ⣻��ּ���ʹ����غ��������ȫ�ֽ⣬û��ʣ�ࣻ�ʷ�Ӧ��ɺ��Թ��в������������Ȼ��ء��������̺�����ء�
��4���������⣬AΪ��Ӧ��ҷ�Ӧ��10g��CDΪ���������C��D�����ֱ�Ϊ8g��4g�����������غ㶨�ɣ��жϳ�BΪ��Ӧ��ҷ�Ӧ��2g��
��A��B��������Ϊ10g��2g=5��1��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�����Ŀ�����о�������кͷ�Ӧ��ʱ��ij��ȤС��ͬѧ��֤��ϡ����������������Һ��Ϻ��Ƿ����˻�ѧ��Ӧ������������̽����
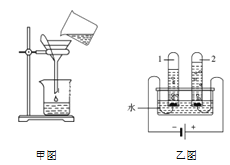
��1����ʢ������������Һ���ձ��е��˼��η�̪��Һ������μ���ϡ���ᣬ�����Ͻ��裨��ͼһ���������ֻ��������������������������Һ���ǰ����¶ȱ仯�������ͼ������
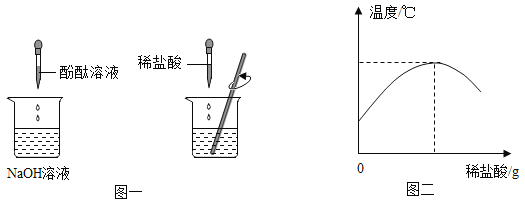
ͼһʵ���еμ�ϡ�������������Ϊ__________________����ʵ����������߱仯���������֪�����������������Һ�����˷�Ӧ��________�����������������ų�����������
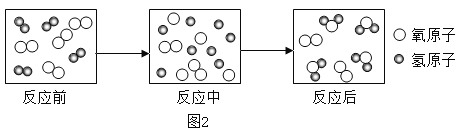
��2�����۽Ƕȷ�������������������Һ�ķ�Ӧ��ͼ�����˸÷�Ӧ����ʵ�ʣ�ͼ��A��B��C��Ӧ����Ļ�ѧ����������____________��

��3��ͬѧ�����ۺ���Ϊ������ü���������������Ƽ��٣�����ʧ�������������������ɣ�����֤����Ӧ�Ѿ�����������̽��ʵ����ձ������ʵijɷ֣���֤����Ӧ�ķ�����
���� | ���� | ���� |
ʵ��1��ȡ�ձ��е���Һ�������Թ��У���������ͭ��Һ | ____________________________ | ֤��û�� |
ʵ��2����ȡ�ձ��е���Һ�������Թ��У�������������Һ | ���ְ�ɫ���� | ֤������ |
ʵ��3����ȡ�ձ��е���Һ�������������У��������� | ��___________���� | ֤���� |
���ó����ۣ�����������Һ�����ᷢ�����кͷ�Ӧ��
�����۷�˼����ͬѧ��Ϊ����ͨ��ʵ��2�ó�����Һ�к���![]() ��֤�ݲ��㣬������___________________��
��֤�ݲ��㣬������___________________��