题目内容
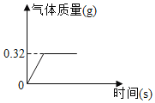
【题目】为测定某过氧化钠样品的纯度,将2 g该样品与足量X发生如下反应(杂质不参与反应):2Na2O2+2X=4NaOH+O2↑,生成气体质量与时间的关系如图所示。回答问题:
(1)过氧化钠中钠、氧元素的质量比为_________;物质X的化学式为__________。
(2)生成氧气的质量是____________g。
(3)计算2克该样品中过氧化钠的质量________________。
【答案】23:16 H2O 0.32 1.56
【解析】
(1)过氧化钠中钠、氧元素的质量比为:(23×2):(16×2)=23:16;根据化学反应前后各种原子个数相等,物质X的化学式为H2O。
(2)根据图像可知,生成氧气的质量是0.32g。
(3)解:设样品中过氧化钠的质量为x。
![]()
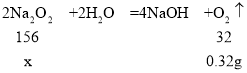
![]() ,解得x=1.56g
,解得x=1.56g

 轻巧夺冠周测月考直通中考系列答案
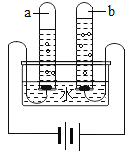
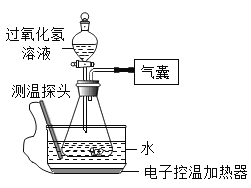
轻巧夺冠周测月考直通中考系列答案【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.5g NaCl | 0.5g FeCl3 | ||||
60分内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定__________来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是__________(填序号)。
(4)通过实验①、②、④可得出的结论是_______________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是____________、____________(答两点)。
(6)你认为影响过氧化氢溶液分解速率的因素还有哪些?请设计实验验证你的猜想
(猜想假设)___________________。
(实验操作)___________________。
(实验结论)___________________。