题目内容
现有NaNO3、AgNO3、HCl、Na2CO3、NaCl、Ca(NO3)2六种溶液,仅Ca(NO3)2溶液瓶上贴有标签.为确定其它五种溶液各是什么,将它们随意编号为A、B、C、D、E后,两两混和进行实验,根据实验现象(如下表所示)回答:
| A | B | C | D | E | |
A | ↓ | ↓ | ↓ | ━ | |
| B | ↓ | ↑ | ━ | ━ | |
| C | ↓ | ↑ | ━ | ━ | |
| D | ↓ | ━ | ━ | ━ | |
| E | ━ | ━ | ━ | ━ |
A______ D______ E______
(2)为了确定B、C物质各是什么,还要进行如下实验.填空回答有关问题:
①从已确定的试剂中选用______作为鉴别试剂最简单.
②向未确定的B、C溶液中分别加入①中选用的鉴别试剂,有白色沉淀生成的原溶液化学式是______无反应现象的原溶液化学式是______.
③A+D反应的化学方程式______.
解:
(1)由于A是与其它物质反应时生成三种沉淀,则可判断该物质是 AgNO3,而 AgNO3不与NaNO3反应,则E为NaNO3;五种物质中氯化钠只与硝酸银反应生成沉淀,故D为NaCl;B、C为Na2CO3和HCl;
(2)确定B、C各是什么,就是确定碳酸钠和稀盐酸,可以加入硝酸钙,有白色沉淀生成的原溶液化学式为Na2CO3,无反应现象的原溶液化学式是HCl;
(3)A(AgNO3)和D(NaCl)反应的化学方程式为:AgNO3+NaCl═AgCl↓+NaNO3.
答案为:
(1)A、AgNO3 D、NaCl E、NaNO3;
(2)①Ca(NO3)2;
②Na2CO3,HCl;
③AgNO3+NaCl═AgCl↓+NaNO3.
分析:该题由于物质较多容易在推断时混乱,建议采用对应法求解,即把其中物质的两两结合找特征物质,此题的特征物质是A生成三种沉淀,然后依此为突破口,按提供的表格对照即可找到答案.
点评:此题是一道推断题,物质设计的较多,解题的关键是对五种物质间的反应及现象的掌握,另外找这种题目的突破口并顺藤摸瓜也是解题的关键点.
(1)由于A是与其它物质反应时生成三种沉淀,则可判断该物质是 AgNO3,而 AgNO3不与NaNO3反应,则E为NaNO3;五种物质中氯化钠只与硝酸银反应生成沉淀,故D为NaCl;B、C为Na2CO3和HCl;
(2)确定B、C各是什么,就是确定碳酸钠和稀盐酸,可以加入硝酸钙,有白色沉淀生成的原溶液化学式为Na2CO3,无反应现象的原溶液化学式是HCl;
(3)A(AgNO3)和D(NaCl)反应的化学方程式为:AgNO3+NaCl═AgCl↓+NaNO3.
答案为:
(1)A、AgNO3 D、NaCl E、NaNO3;
(2)①Ca(NO3)2;
②Na2CO3,HCl;
③AgNO3+NaCl═AgCl↓+NaNO3.
分析:该题由于物质较多容易在推断时混乱,建议采用对应法求解,即把其中物质的两两结合找特征物质,此题的特征物质是A生成三种沉淀,然后依此为突破口,按提供的表格对照即可找到答案.
点评:此题是一道推断题,物质设计的较多,解题的关键是对五种物质间的反应及现象的掌握,另外找这种题目的突破口并顺藤摸瓜也是解题的关键点.

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
为了测定氯酸钾样品(含杂质)中氯酸钾的质量分数,取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
(2)完全反应后产生氧气的质量是______;
(3)计算该样品中氯酸钾的质量分数.
浩瀚的海洋中蕴藏着丰富的自然资源,现摘取部分海水综合利用的方案如下:
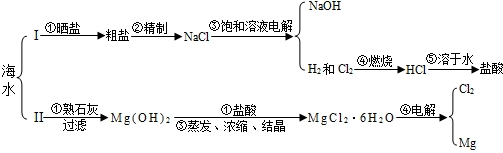
请根据下列部分酸碱盐溶解性表回答下列问题:
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
①过滤 ②溶解 ③蒸发
(2)过滤后所得滤液仍然浑浊,可能的原因是______;
①滤纸破损 ②过滤时漏斗里的液面高于滤纸的边缘 ③漏斗颈下端管口没有紧靠烧杯内壁.
(3)如果海水中含有的可溶性杂质主要为CaCl2、MgSO4,则方案Ⅰ中步骤②“精制”时:欲沉淀杂质CaCl2,一般加入稍过量的碳酸钠溶液,此反应方程式为______;
如果井水或溪水中含有Ca2+、Mg2+,这种水称作______,如果在这种水中加入肥皂,会出现______.
(4)方案Ⅱ中步骤①生成Mg(OH)2的反应方程式为______;
如果熟石灰是用海边的贝壳(主要成分为CaCO3)生成的,则生产熟石灰的反应方程式为:______、______.
(5)方案Ⅱ中除步骤①中用过滤外,还要用到“过滤”步骤的是______(填序号).
(6)下图是某种加钙食盐包装袋标签上的部分说明文字(Ca-40,C-12,O-16):
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
(7)某化工厂为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水制成252g溶液,再加入53g溶质质量分数为10%的碳酸钠溶液,恰好完全反应.求:
①样品中杂质CaCl2的质量;
②样品中氯化钠的质量;
③样品中氯化钠的质量分数;
④反应后所得溶液中溶质的质量分数.
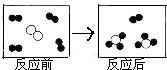

 分别表示X、Y、Z三种不同的气体分子,其在一定条件下反应前后的变化如图所示.下列叙述错误的是
分别表示X、Y、Z三种不同的气体分子,其在一定条件下反应前后的变化如图所示.下列叙述错误的是