题目内容
某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
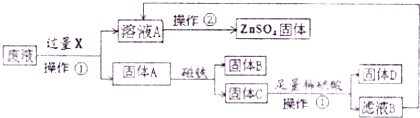
试回答:
(1)X物质的化学式为______.
(2)操作②的名称为______,操作①、②中都要用到的玻璃仪器是______.
(3)加入的稀硫酸目的是______.
(4)写出废液加入过量X的一个反应化学方程式:______.
(5)上述实验过程所涉及三种金属的活动性顺序:______>______>______.
解:(1)根据金属的活动性锌>铁>氢>铜,为回收有关金属和盐,且不增加新的杂质,因此向CuSO4、ZnSO4、FeSO4混合溶液中加入过量锌粉把溶液中的铁与铜置换出来;
(2)操作②是把溶液变成固体,因此是蒸发;操作①把混合物分离成固体和滤液,所以,操作①为过滤操作;因此操作①、②中都要用到的玻璃仪器是玻璃棒,蒸发中玻璃棒是使液体受热均匀,防止液体溅出,过滤中玻璃棒起到引流的作用;
(3)加入的稀硫酸是把铜粉与锌粉的混合物进行分离,锌与稀硫酸反应生成硫酸锌回收,并分离出铜;
(4)根据金属活动性顺序表:Zn>Fe>Cu,排在前面的金属一般能把排在后面的金属从其盐溶液里置换出来;所以,向废液中加入过量的锌粉,发生的化学反应化学方程式是Zn+CuSO4=ZnSO4+Cu;Zn+FeSO4═ZnSO4+Fe;
(5)通过实验的设计,所涉及三种金属的活动性顺序是:锌>铁>铜;
故答案为:(1)Zn;(2)蒸发 玻璃棒;(3)锌与稀硫酸反应生成硫酸锌回收,并分离出铜;
(4)Zn+FeSO4=ZnSO4+Fe (或Zn+CuSO4=ZnSO4+Cu );
(5)Zn Fe Cu (或锌 铁 铜).
分析:由实验流程图可判断,操作1完成后原混合物分成了固体和滤液两部分,利用这一特点可判断操作1为过滤操作;根据铜、锌、铁三种金属的活动性判断向混合溶液中加入过量锌粉后所得固体的组成:锌、铁、铜;三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种金属分为两组:一组为铁粉(固体B),另一组为铜粉和锌粉的混合物(固体C);过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液反应后所得溶液为ZnSO4溶液,铜粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为ZnSO4溶液,经过蒸发得到硫酸锌固体.
点评:本题结合实验回收硫酸锌和有关金属,考查了金属活动性顺序表的应用,解题时只要抓住反应过程中金属与盐溶液的反应实质,并结合相关的实验过程就能顺利解题,培养了学生分析题意获取信息,根据信息推导做题的能力.
(2)操作②是把溶液变成固体,因此是蒸发;操作①把混合物分离成固体和滤液,所以,操作①为过滤操作;因此操作①、②中都要用到的玻璃仪器是玻璃棒,蒸发中玻璃棒是使液体受热均匀,防止液体溅出,过滤中玻璃棒起到引流的作用;
(3)加入的稀硫酸是把铜粉与锌粉的混合物进行分离,锌与稀硫酸反应生成硫酸锌回收,并分离出铜;
(4)根据金属活动性顺序表:Zn>Fe>Cu,排在前面的金属一般能把排在后面的金属从其盐溶液里置换出来;所以,向废液中加入过量的锌粉,发生的化学反应化学方程式是Zn+CuSO4=ZnSO4+Cu;Zn+FeSO4═ZnSO4+Fe;
(5)通过实验的设计,所涉及三种金属的活动性顺序是:锌>铁>铜;
故答案为:(1)Zn;(2)蒸发 玻璃棒;(3)锌与稀硫酸反应生成硫酸锌回收,并分离出铜;
(4)Zn+FeSO4=ZnSO4+Fe (或Zn+CuSO4=ZnSO4+Cu );
(5)Zn Fe Cu (或锌 铁 铜).
分析:由实验流程图可判断,操作1完成后原混合物分成了固体和滤液两部分,利用这一特点可判断操作1为过滤操作;根据铜、锌、铁三种金属的活动性判断向混合溶液中加入过量锌粉后所得固体的组成:锌、铁、铜;三种金属单质中,只有铁能被磁铁所吸起,因此使用磁铁吸引后,三种金属分为两组:一组为铁粉(固体B),另一组为铜粉和锌粉的混合物(固体C);过量锌粉与CuSO4、ZnSO4、FeSO4混合溶液反应后所得溶液为ZnSO4溶液,铜粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为ZnSO4溶液,经过蒸发得到硫酸锌固体.
点评:本题结合实验回收硫酸锌和有关金属,考查了金属活动性顺序表的应用,解题时只要抓住反应过程中金属与盐溶液的反应实质,并结合相关的实验过程就能顺利解题,培养了学生分析题意获取信息,根据信息推导做题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
实验一:探究碳酸氢钠溶液的酸碱性
取碳酸氢钠溶液少许,滴加无色酚酞溶液变红,由此可知碳酸氢钠溶液呈______性.
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
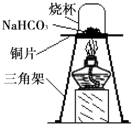
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有______生成.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:______.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①兴趣小组的同学猜想的依据是______.
②请设计实验检验反应后的固体产物是NaOH还Na2CO3,并填入下表:
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 取少量固体产物,向其中加入______. | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH. |
 某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究. 化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:
化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如: