题目内容
【题目】图A、B是实验室制气体的常用装置.
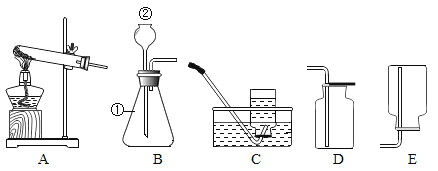
(1)过氧化氢分解制取O2分液漏斗中应放入的物质是____,锥形瓶中应放入的物质是_____.写出该方法制取O2的化学方程式______.
(2)如用高锰酸钾制氧气,制取一瓶较纯净的氧气选用的装置是_______,写出该方法制取O2的化学方程式_______。
(3)实验中观察到何种现象时开始收集?_________.
(4)为了测定实验中氯酸钾样品的纯度,某学习小组取2.5克该样品与0.8克二氧化锰混合。加热该混合物到不再产生气体为止,称量剩余固体质量为2.34g,回答下列问题:
①求完全反应后生成氧气的质量________;
②求该样品中氯酸钾的质量________。
【答案】过氧化氢溶液 二氧化锰 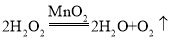 AC
AC 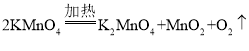 C中有连续均匀的气泡出现 0.96g 2.45g
C中有连续均匀的气泡出现 0.96g 2.45g
【解析】
(1)通过长颈漏斗加入液体,过氧化氢分解制取O2分液漏斗中应放入的物质是过氧化氢溶液,锥形瓶中应放入的物质是二氧化锰,该反应的化学方程式为: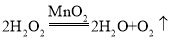 。
。
(2)加热固体制取气体,选择发生装置A,用排水法收集的气体较纯净,如用高锰酸钾制氧气,制取一瓶较纯净的氧气选用的装置是AC,该反应的化学方程式为: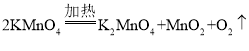 。
。
(3)C中有连续均匀的气泡出现时,水纯净的氧气,此时开始收集。
(4)解:①根据质量守恒定律,生成氧气的质量为:2.5g+0.8g-2.34g=0.96g;
②设该样品中氯酸钾的质量为x。

![]() ,解得x=2.45g
,解得x=2.45g
答:该样品中氯酸钾的质量为2.45g。

练习册系列答案
相关题目