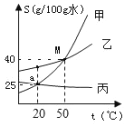
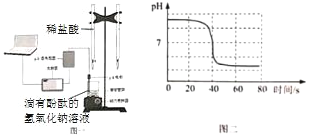
题目内容
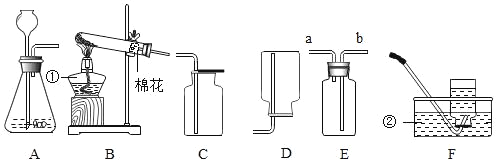
【题目】实验小组同学用如图所示装置测定空气中氧气的含量。

(1)连接仪器,检查装置气密性。点燃燃烧匙内足量的红磷后,立即伸入瓶中并塞紧瓶塞。实验中发生反应的化学方程式为___________________。
(2)冷却至室温后打开止水夹,烧杯中的水倒吸入集气瓶中的原因是________________________。
(3)该实验所得到的结论是______________________。
【答案】4P+5O2![]() 2P2O5 红磷燃烧消耗氧气,使瓶内压强减小 氧气约占空气体积的五分之一
2P2O5 红磷燃烧消耗氧气,使瓶内压强减小 氧气约占空气体积的五分之一
【解析】
(1)红磷在空气中燃烧,实质上是和空气中的氧气反应生成五氧化二磷,方程式故填4P+5O2![]() 2P2O5 ;
2P2O5 ;
(1)红磷燃烧消耗集气瓶内氧气,使瓶内气体压强减小,冷却至室温后打开止水夹,烧杯中的水倒吸入集气瓶,故填红磷燃烧消耗氧气,使瓶内压强减小;
(3)红磷燃烧消耗集气瓶内约占空气体积五分之一的氧气,水进入集气瓶下方第一刻度处,说明空气中氧气约占五分之一,故填氧气约占空气体积的五分之一。

【题目】为研究化学反应前后,反应物与生成物之间的质量关系,三位同学分别做了这样三个实验。

实验一:称量镁条的质量,在空气中点燃,待反应结束、冷却后,再称量生成白色固体的质量。
实验二:如图甲,将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后将两种溶液混合 (有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。
实验三:如图乙,将装有稀盐酸的小试管放入装有大理石的烧杯中,称量,然后将稀盐酸与大理石混合,过一会儿再称量。实验数据见表:
编号 | 实验一 | 实验二 | 实验三 |
变化前 | 4.8g | 118.4g | 112.6g |
变化后 | 8.0g | 118.4g | 111.0g |
(1)表中数据看,这三个实验过程中,发生化学反应的前后物质质量(填“减小“增大”或“不变”):实验一______,实验二_____,实验三_____。
⑵这三个实验中,实验___(选填:“一”、“二”或“三”)正确地反映了反应物与生成物之间的质量关系。
⑶从不能正确反映反应物和生成物之间质量关系的实验中,选择其中一个说明实验设计中的不当之处___,请写出该实验所发生反应的化学方程式_____。
⑷由此可得出,在选用有气体参加或生成的化学反应来验证质量守恒定律时,必须在_____(填“密闭”或“开放”)的体系中进行。