题目内容
【题目】认识溶液的变化。
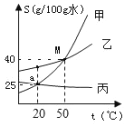
(1)根据如图甲、乙、丙三种固体的溶解度曲线回答:
①M 点表示的含义是_____。
②50℃时,将 40g 甲物质投入到 50g 水中,形成的溶液中溶质与溶剂的质量比为_____。
③20℃时,处于 a 点状态甲溶液,升温至 50℃,溶质质量分数_____(填“变大”、“变小”或“不变”)。
④分别将 50℃的三种物质的饱和溶液 100g 降温到 20℃时,甲、乙、丙溶液质量大小关系为_____。
(2)图一是利用 pH 传感器探究氢氧化钠溶液与稀盐酸的反应,图二是该反应的 pH 变化曲线。根据下图回答:
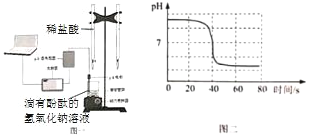
①氢氧化钠溶液与稀盐酸反应的化学方程式为_____。
②向烧杯中缓慢滴入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的现象是_____。
③60s 时,烧杯内溶液中的溶质有_____。
④依据以上实验,说法正确的是_____。
A.实验中 NaCl 的质量分数一直在变大
B.实验中 NaOH 的质量在不断地变小直至为 0
C.一段时间后,溶液 pH 一定会变为 0
D.选用 pH 试纸也可以证明稀盐酸和氢氧化钠溶液能发生化学反应
【答案】50℃时甲乙两种物质的溶解度相同,为40g 2:5 不变 丙>乙>甲 NaOH+HCl==NaCl+H2O 溶液由红色变为无色 NaCl、HCl BD
【解析】
(1)①M 点表示的含义是在50℃时甲乙两种物质的溶解度相等,为 40g。②50℃时,甲的溶解度是40g,则50g 水中最多能溶解20g甲,将 40g 甲物质投入到50g 水中,形成的溶液中溶质与溶剂的质量比为20g:50g=2:5。③20℃时,处于 a 点状态的甲溶液是20℃时的饱和溶液,升温至 50℃,溶解度变大,由于溶质质量、溶剂质量都不变,所以溶质质量分数不变。④分别将 50℃的三种物质的饱和溶液 100g 降温到 20℃时,丙无晶体析出,甲、乙析出晶体,由于甲的溶解度受温度影响大,甲析出的晶体较多,甲、乙、丙溶液质量大小关系为丙>乙>甲。
(2)①氢氧化钠溶液与稀盐酸反应生成氯化钠和水。②酚酞遇碱性溶液变红,遇中性或酸性溶液不变色,滴有酚酞的氢氧化钠溶液滴加盐酸后红色消失,说明溶液不是碱性了,即氢氧化钠和盐酸发生了反应。③60s 时,溶液的pH<7,溶液显酸性,说明盐酸有剩余,溶液中的溶质有NaCl、HCl。④A. 当氢氧化钠与稀盐酸反应完以后,再滴加稀盐酸, NaCl 的质量分数变小,此选项错误;B. 随着反应的进行,实验中 NaOH 的质量在不断地变小,当氢氧化钠与稀盐酸恰好反应时,NaOH 的质量为0,此选项正确;C. 反应过程中溶液的碱性减弱、酸性增强,当酸过量时,溶液显酸性,但一段时间后,溶液 pH不会变为 0,此选项错误;D. pH 试纸可测定溶液的酸碱度,酸碱度是表示溶液酸碱性强弱程度的,选用 pH 试纸也可以证明稀盐酸和氢氧化钠溶液能发生化学反应,此选项正确。故选BD。

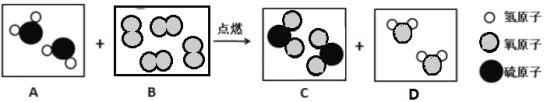
【题目】以焦炭和碳酸钙为原料生产碳化钙( CaC2 ),并制备重要工业原料乙炔( C2 H2 )气体, 其工艺流程如下图:
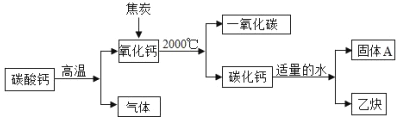
(1)写出碳酸钙分解的化学方程式_____。
(2)将氧化钙和焦炭反应的化学方程式补充完整, CaO + C CaC2 CO ;生成的 CO 不能排放到空气中,是因为_____。
(3)猜想:固体 A 的成分可能是氢氧化钙或碳酸钙。
设计实验证明猜想。
实验 | 现象 | 结论 |
_____ | _____ | 固体A的成分不是碳酸钙 |
【题目】某同学将如下实验一反应后的物质和实验二反应后的硬质玻璃管中的物质倒入同一个容器内,发现有化学反应发生,于是便对容器内反应后的物质成分探究产生了兴趣。
(查阅资料):Fe2O3 + 6HCl = 2FeCl3 + 3H2O
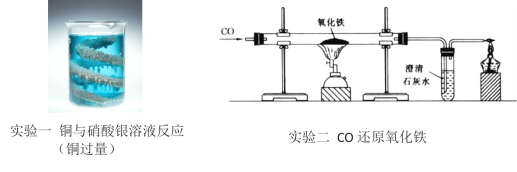
(讨论分析)同学们经过讨论分析,认定该容器内物质混合后会发生化学反应,化学方程式为______.
(设计实验)为进一步确定容器内物质成分,同学们做了以下探究,请完成填空。
实验步骤 | 实验现象 | 实验结论 |
一、把容器内的混合物过滤,得到固体和溶液,将固体烘干,用磁铁吸引固体。 | ___________ | 固体中不含铁。 |
二、取少量步骤一固体,加入过________。 | 固体粉末减少,溶液变成黄色 | 固体中一定含有_________。 |
三、___________ | ___________ | 溶液中含有硝酸铜 |
(问题探讨)混合物中不含单质铁的原因是___________。