题目内容
(6分)实验室有一瓶氯化钠和碳酸钠的混合物,某同学为了确定它的组成做了如下实验:首先取l 6 g混合物放入烧杯中,然后向烧杯中滴加稀盐酸,直到不再产生气泡为止,共加入稀盐酸159.4 g,测得反应后剩余物质的总质量为171 g。求:
(1)此瓶混合物中所含碳酸钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
(1)此瓶混合物中所含碳酸钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
(6分)解:(1)设混合物中含Na2CO3的质量为x,生成的NaCl的质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x Y l 6 g+159.4g-171 g
x=10.6 g y=11.7 g
混合物中所含碳酸钠的质量分数为66.25%
(2)反应后所得溶液中溶质的质量分数为10%
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x Y l 6 g+159.4g-171 g
x=10.6 g y=11.7 g
混合物中所含碳酸钠的质量分数为66.25%
(2)反应后所得溶液中溶质的质量分数为10%
分析:分析反应可知,碳酸钠与盐酸反应放出的二氧化碳使反应后物质总质量减少,根据质量质量守恒,由反应前后物质总质量的差可计算出放出二氧化碳的质量;由生成的二氧化碳的质量可计算混合物中碳酸钠的质量及反应后生成氯化钠的质量,反应后溶液中氯化钠的质量为原混合物中氯化钠与反应生成氯化钠的质量和.
解答:解:根据质量守恒定律,生成二氧化碳的质量为:l6g+159.4g-171g=4.4g
设混合物中含Na2CO3的质量为x,生成的NaCl的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
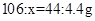 x=10.6g
x=10.6g
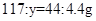
y=11.7g
混合物中所含碳酸钠的质量分数=
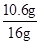 ×100%=66.25%
×100%=66.25%
反应后所得溶液中溶质的质量分数=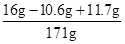 ×100%=10%
×100%=10%
答:(1)此瓶混合物中所含碳酸钠的质量分数为66.25%;(2)反应后所得溶液中溶质的质量分数为10%.
点评:根据质量守恒定律,找出反应放出二氧化碳气体的质量是解决本问题的基础.
解答:解:根据质量守恒定律,生成二氧化碳的质量为:l6g+159.4g-171g=4.4g
设混合物中含Na2CO3的质量为x,生成的NaCl的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
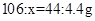 x=10.6g
x=10.6g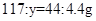
y=11.7g
混合物中所含碳酸钠的质量分数=
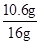 ×100%=66.25%
×100%=66.25%反应后所得溶液中溶质的质量分数=
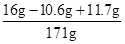 ×100%=10%
×100%=10%答:(1)此瓶混合物中所含碳酸钠的质量分数为66.25%;(2)反应后所得溶液中溶质的质量分数为10%.
点评:根据质量守恒定律,找出反应放出二氧化碳气体的质量是解决本问题的基础.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
 2Na+3N2↑,若生成钠23g,则同时产生氮气的质量是多少?
2Na+3N2↑,若生成钠23g,则同时产生氮气的质量是多少?


