题目内容
(3分)
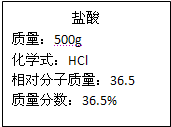
现将71.9g高锰酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为65.5g。
请计算:
(1)生成氧气多少克?
(2)反应后剩余固体中钾、锰两种元素的质量比
现将71.9g高锰酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为65.5g。
请计算:
(1)生成氧气多少克?
(2)反应后剩余固体中钾、锰两种元素的质量比
(1)6.4克
(2)156:275
(1)生成氧气的质量为:71.9g--65.5g=6.4g………(1分)
(2)解法一:设原混合物中含高锰酸钾的质量为x2KMnO4="===K2MnO4+MnO2+" O2↑
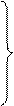 316 32
316 32
x 6.4g
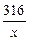 =
= 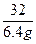
x="63.2g" …………………………………………(1分)
反应前固体混合物中:钾元素的质量=63.2g×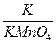 =15.6g
=15.6g
锰元素的质量=63.2g×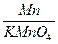 +(71.9g-63.2g)×
+(71.9g-63.2g)×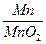 =27.5g
=27.5g
据质量守恒定律,反应前后钾、锰元素的质量不变,故反应后固体混合物中,钾、锰元素的质量比为156:275 ……………………(1分)
|
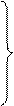 316 32
316 32x 6.4g
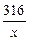 =
= 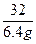
x="63.2g" …………………………………………(1分)
反应前固体混合物中:钾元素的质量=63.2g×
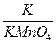 =15.6g
=15.6g锰元素的质量=63.2g×
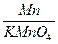 +(71.9g-63.2g)×
+(71.9g-63.2g)×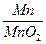 =27.5g
=27.5g据质量守恒定律,反应前后钾、锰元素的质量不变,故反应后固体混合物中,钾、锰元素的质量比为156:275 ……………………(1分)

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 a)g
a)g