题目内容
【题目】向碳酸钠和氯化钠的混合物15.6g中加入100g稀盐酸,恰好完全反应后,得到111.2 g溶液。试计算:
(1)根据质量守恒定律得,产生二氧化碳质量为______;
(2)稀盐酸溶液中溶质的质量分数是________?(Na2CO3+2HCl=NaCl+H2O+CO2↑.相对原子质量Na:23 C:12 O:16 H:1 Cl:35.5)
【答案】4.4g 15%
【解析】
(1)产生二氧化碳的质量为:15.6g+100g-111.2g=4.4g,
答:产生二氧化碳的质量是4.4g。
(2)解:设碳酸钠的质量为x,生成氯化钠的质量为y,
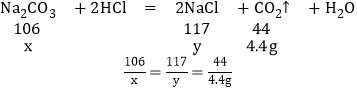
x=10.6g,y=11.7g,
碳酸钠和氯化钠的混合物中,氯化钠的质量为:15.6g-10.6g=5.0g,
所得溶液中溶质中,溶质氯化钠的质量为:11.7g+5.0g=16.7g,
所得溶液中溶质的质量分数为:![]()

【题目】某化学兴趣小组为探究化学反应中的能量变化,进行以下实验:
(探究一)盐酸与氢氧化钠的反应
(1)写出氢氧化钠溶液与盐酸反应的化学方程式:_________________________________。
(2)甲同学设计实验:向一定量氢氧化钠固体中倒入20mL 4%盐酸,用温度计测量反应前后各溶液的温度。乙同学认为该实验方案不合理,其理由是_________________________。
(3)丙同学设计了如下三组实验,请你帮助他完成实验方案:
实验编号 | 实验方案 |
实验1 | 向20mL 4%盐酸中倒入20mL水,测定稀释前后溶液的温度。 |
实验2 | 向20mL 5%氢氧化钠溶液中________________,测定稀释前后溶液的温度。 |
实验3 | _______________________________________________________________。 |
(4)丙同学观察到的实验现象是:实验3溶液升高的温度远大于实验1与实验2溶液升高的温度之和,由此你能得出的实验结论是①____________;②____________。
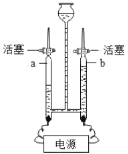
(探究二)盐酸与碳酸氢钠溶液的反应。
下图是丁同学在20℃、基本隔热条件下利用温度传感器,分别测定向20mL水和20mL饱和碳酸氢钠溶液中各倒入20mL 13.7%盐酸的温度与时间变化曲线。
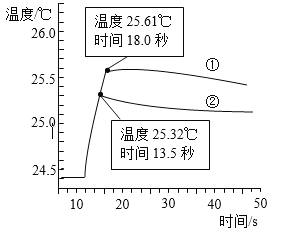
曲线①为水+13.7%盐酸温度变化曲线
曲线②为饱和碳酸氢钠溶液+13.7%盐酸温度变化曲线
实验测得饱和碳酸氢钠溶液稀释时温度变化不大,可忽略不计,据此回答下列问题:
(5)18.0秒后,曲线①逐渐下降的原因是____________________________________;
(6)比较曲线①和曲线②,你认为13.7%盐酸与饱和碳酸氢钠溶液的反应是________(填“放热”或“吸热”)反应,其理由是_________________________。