题目内容
【题目】以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图。
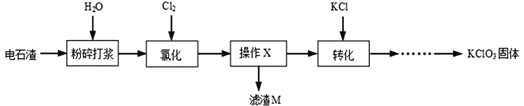
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6 Ca(OH)2 + 6 Cl2 = Ca(ClO3)2 + 5CaCl2 + aH2O
(1)氯化前,先将电石渣粉碎的目的是___________。
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为_______________价,a数值为___________。
(3)操作X为______________。转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为_____________。(相关物质的溶解度见下图)
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③___________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入_______; | 观察到___________现象 | 猜想①不正确 |
步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到___________现象 | 猜想③正确 |
【答案】 增大反应物的接触面积,使反应更快更充分 +5 6 过滤 Ca(ClO3) 2+2KCl CaCl2+2KClO3↓ Ca(OH) 2和CaCO3 加入酚酞(或CuSO4溶液、FeCl3溶液) 变红(或产生蓝色沉淀、红褐色沉淀)(合理即可) 有气泡产生
【解析】电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3;
(1)将电石渣粉碎可以增大反应物与水的接触面积,使反应更快更充分;
(2)氯酸钙Ca(ClO3)2中Ca元素化合价为+2价,氧元素化合价为-2价,根据化合物中各元素正负化合价的代数和为0,计算出Cl的化合价为+5价,化学反应前后原子种类和数目均不发生改变,根据氢原子守恒可知6×2=a×2,则a=6;
(3)操作的目的为除去溶液中不溶性的杂质,应为过滤;根据KClO3、CaCl2、Ca(ClO3)2、KCl四种物质的溶解度,Ca(ClO3)2与KCl发生复分解反应生成KClO3的化学方程式为Ca(ClO3) 2+2KCl=CaCl2+2KClO3↓;
(4)【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2的混合物;
【实验验证】
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先滴加酚酞,溶液变红,说明溶液显碱性,滤渣中一定含有Ca(OH)2,则猜想①不正确;
步骤2:向小烧杯中继续加入足量的稀盐酸,观察到有气泡产生,说明有碳酸钙存在,则滤渣中有Ca(OH)2和碳酸钙,故猜想③正确。

 互动英语系列答案
互动英语系列答案【题目】在一密闭容器中有甲、乙、丙、丁四种物质,一定条件下使之反应,一段时间后测得反应前后各物质的质量如下:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 90 | 9 | 0 | 2 |
反应后质量/g | 22 | 45 | 32 | X |
(1)此反应的基本反应类型______________;
(2)X的值___________,则丁可能是该反应的______________。
(3)写出一个符合上述反应类型的化学方程式_____________________________________ 。
【题目】草木灰是农家肥料,它是指山草、禾秆和树枝等燃烧后的灰烬(不包括由煤所产生的煤炭),主要成分是碳酸钾,还含有硫酸钾、氯化钾。为了确定草木灰的成分,进行了以下实验。
(提供的试剂: ![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、稀硝酸、稀盐酸)
溶液、稀硝酸、稀盐酸)
步骤1:取适量草木灰样品于烧杯中,加入过量_____________(填化学式),搅拌,产生大量无色气泡,说明草木灰含有碳酸钾。
请你接着上面的实验继续完成下列步骤:
实验操作 | 预期实验现象与结论 |
步骤2:将步骤1的混合物过滤,取少量滤液于试管中,加入过量的______________。 | _____________________________,说明草木灰中含有硫酸钾 |
步骤3:________________________。 | ___________________________。 |